Julia Alves Utyama; Guilherme Novoa Colombo Barboza; Roberta de Júlio Matheus; Marcello Novoa Colombo Barboza
DOI: 10.17545/eOftalmo/2021.0024
RESUMO
O Vírus Herpes Simples (HSV) é um patógeno comum, caracterizado por sua alta prevalência mundial. O HSV-1 é o responsável pelos quadros oculares e sua transmissão ocorre através da saliva infectada ou do contato direto com lesões ativas. A infecção primária pode ser assintomática e autolimitada, levando à latência do vírus nos gânglios sensoriais, como o gânglio trigêmeo. A reativação da infecção normalmente decorre de fatores imunocomprometedores, infecções febris, traumas ou exposição solar e sua severidade está diretamente relacionada à capacidade imunológica do hospedeiro. Outro aspecto relevante é o número crescente de casos de sarampo no Brasil e no mundo nos últimos anos. Trata-se de uma doença viral altamente contagiosa, que se manifesta com exantemas, febre alta, coriza e conjuntivite. E frente à este cenário, é fundamental entender que as alterações imunológicas provocadas pelo vírus podem ser o principal fator determinante do curso da doença e suas complicações, onde otite média, pneumonia e ceratoconjuntivite são as mais comuns. O objetivo deste estudo é relatar um caso de ceratite herpética multifocal concomitante à infecção ativa por sarampo em paciente jovem e imunocompetente, além de ressaltar a importância do pronto conhecimento da infecção pelo HSV e sua característica oportunista.
Palavras-chave: Ceratite herpética; Herpes Simples; Sarampo; Conjuntivite.
ABSTRACT
The herpes simplex virus (HSV) is a common pathogen that is characterized by its high worldwide prevalence. HSV1 can cause ocular conditions and is spread through infected saliva or direct contact with active lesions. Primary infection can be asymptomatic and self-limited, leading to virus latency in sensory ganglia, such as the trigeminal ganglion. Reactivation of the infection usually results from immunocompromising factors, febrile infections, trauma, or exposure to sunlight, and its severity is directly related to the host’s immune capacity. Another relevant aspect is the increasing incidence of measles in Brazil and worldwide in recent years. Measles is a highly contagious viral disease that manifests with rashes, high fever, runny nose, and conjunctivitis. Against this background, it is essential to understand that immunological changes caused by the virus may be the main determinant of the course of the disease and its complications, of which otitis media, pneumonia and keratoconjunctivitis are the most common. The objectives of this study were to describe a case of multifocal herpetic keratitis concomitant with active measles infection in a young, immunocompetent patient and to emphasize the importance of awareness of HSV infection and its opportunistic nature.
Keywords: Herpetic keratitis; Herpes simplex; Measles; Conjunctivitis.
INTRODUÇÃO
O vírus do herpes simples (HSV) é um patógeno humano comum, classificado em HSV-1 e HSV-2. O HSV-1 caracteriza-se por quadros extragenitais, disseminando-se através da saliva infectada ou lesões ativas, enquanto que o HSV-2 envolve quadros perigenitais, sexualmente transmissíveis1. Além disso, é caracterizado por sua endemia em praticamente todas as sociedades humanas2. Estudos mostram que 18,2% do cadáveres de 0-20 anos apresentam o HSV, detectados teste molecular de reação em cadeia da polimerase (PCR), no gânglio trigêmeo, chegando a quase 100% dos cadáveres acima de 60 anos3.
A infecção ocular herpética pode ser primária ou recorrente. A infecção primária pelo HSV pode apresentar-se como ceratoconjuntivite aguda ou assintomático e autolimitado. Após o primeiro contato, o vírus permanece em estágio latente nos gânglios sensoriais até a reativação da replicação viral. A recorrência da infecção é, na maioria das vezes, decorrente de fatores desencadeantes como infecções febris, exposição solar, exaustão física ou emocional, podendo acometer desde as pálpebras, conjuntiva, córnea, íris ao seguimento posterior do globo ocular4,5.
A proteção contra o vírus é predominantemente dependente de células T, atribuindo-lhe uma característica oportunista. Sendo assim, além da virulência do vírus e vulnerabilidade do tecido acometido, o mecanismo de defesa imune do indivíduo pode determinar a gravidade e apresentação da infecção6,7.
Nos últimos anos, casos de sarampo têm sido reportados em várias partes do mundo. Segundo o Ministério da Saúde, o Brasil apresenta surtos em suas 5 regiões com 15.7434 casos notificados e 7.939 casos confirmados no período de dezembro de 2019 a setembro de 2020, mais concentrados nos estados do Pará, São Paulo, Paraná e Santa Catarina8. Trata-se de uma doença exantemática, infecciosa e altamente contagiosa, causada pelo vírus RNA da família Paramoxyviridae, transmitido de 4 a 6 dias antes do exantema até 4 dias após. O quadro clínico é caracterizado por febre alta, exantema máculo-papular generalizado, manchas de Koplik em orofaringe, coriza e conjuntivite9. O quadro ocular do sarampo geralmente apresenta reação conjuntival papilar-folicular com hiperemia podendo ou não comprometer a córnea e evoluir com complicações como, ceratite, perfuração ocular e corirretinite10,11. Além disso, estudos mostram que a infecção pode acarretar anormalidades na resposta imunológica de monócitos e linfócitos, imunossuprimindo temporariamente os indivíduos afetados e aumentando o risco de infecções secundárias no período12-14.
Frente ao atual aumento da incidência de sarampo no país e à elevada prevalência do HSV na população, o entendimento do caráter imunossupressor do sarampo e oportunista do HSV, se tornam fundamental para o diagnóstico e instituição do tratamento apropriados. Sendo assim, o presente estudo tem como objetivo relatar um quadro ocular atípico de ceratite herpética em paciente jovem imunocompetente com infecção ativa por sarampo.
RELATO DO CASO
Homem, 24 anos, comparece ao serviço ambulatorial do Hospital Oftalmológico Visão Laser, da cidade de Santos-SP com queixa de vermelhidão e sensação de corpo estranho em olho direito (OD) há 8 dias, acompanhados de tosse e coriza. Refere também que 4 dias após o início dos sintomas evoluiu com febre alta e erupções cutâneas avermelhadas que iniciaram em região retro auricular e progrediu para o corpo, estando presentes até o momento. Com o aparecimento das lesões, procurou o pronto socorro onde foi submetido ao exame de sorologia que resultou em IgM positivo para sarampo. Nega comorbidades e antecedentes oftalmológicos relevantes. O exame físico geral mostrou exantema cutâneo máculo-papular de coloração vermelha em membros, tronco e face com áreas descamativas. Ao exame oftalmológico: acuidade visual (AV) sem correção de 20/20 em ambos os olhos (AO). À biomicroscopia, hiperemia conjuntival 2+ com reação folicular em conjuntivas tarsais e secreção mucosa em OD; olho esquerdo sem alterações. Foi prescrito colírios lubrificantes 1 gota 4 vezes ao dia, compressas frias 3 vezes ao dia e retorno em 7 dias.
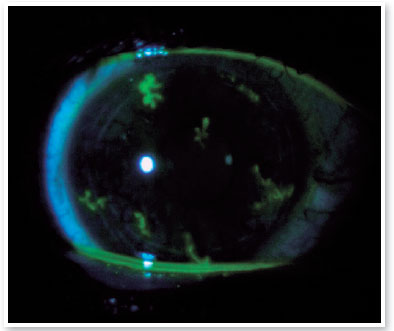
Após 3 dias da primeira avaliação, o paciente retorna referindo diminuição da AV em OD e fotofobia. Ao exame, OD apresentava córnea com lesões dendríticas em toda superfície corneana fluoresceína positivo, configurando ceratite herpética difusamente distribuída (Figura 1). Prescrito Aciclovir 400mg via oral 5 vezes ao dia (2g por dia) por 10 dias, mantido o colírio lubrificante 4 vezes ao dia e reavaliação em 5 dias. Ao retorno o paciente se apresentava sem queixas e OD mostrou diminuição significativa no tamanho e número das lesões herpéticas que se resolveram completamente com 10 dias de tratamento anti-viral.
DISCUSSÃO
O HSV é um patógeno mundialmente endêmico e seu único reservatório conhecido é o homem. Em pesquisa do vírus por PCR no gânglio trigêmeo, estudos mostraram que o mesmo está presente em pelo menos 90% da população mundial de até 60 anos na forma latente15-17. A ceratite herpética é o quadro mais comum na recorrência da infecção e sua fisiopatologia está diretamente relacionada à replicação viral no epitélio corneano. Contudo manifestações clínicas distintas podem ocorrer, a depender da camada corneana acometida e do mecanismo fisiopatogênico envolvido4. Geralmente, a ceratite epitelial infecciosa cursa com vesículas, úlceras dendríticas e localizadas características, porém, em indivíduos incapazes de conter o vírus por deficiência da imunológica, as manifestações clínicas podem ser mais evidentes. A literatura sugere que qualquer condição depressora da resposta imune celular-mediada, como pós-transplante18,19, diabetes mellitus20, sarampo21,22, ou HIV23, predispõem quadros atípicos, mais graves e recorrentes de ceratite herpética4,24,25.
O sarampo é uma doença viral aguda e altamente contagiosa, sendo o homem seu único reservatório. Além da febre caracteristicamente alta, a vasculite generalizada é a maior responsável pelas manifestações clínicas características, porém sua morbimortalidade é mais atribuída ao aumento da suscetibilidade a infecções secundárias9,26. Muitos estudos mostram que a resposta imune ao vírus do sarampo é paradoxalmente associada à sua supressão contra outros antígenos, podendo permanecer assim semanas após a resolução do quadro24,26,27. Anormalidades tanto na resposta imune inata de monócitos, quanto na adaptativa linfocitária foram relatadas após a infecção pelo vírus do sarampo28,29.
Apesar de existirem dados na literatura que fundamentam a relação da infecção pelo vírus do sarampo com HSV, há poucos casos relatados focados em esclarecer os mecanismos fisiopatogênicos que podem interligar essas doenças. Portanto, frente ao caso relatado, à elevada incidência de sarampo e a alta prevalência do HSV na população, conclui-se que é fundamental reconhecer a ceratite herpética como possível complicação nos quadros de sarampo. Além disso, devido ao estado imunossupressor em que o paciente se encontra, é importante valorizar as possíveis variações na apresentação clínica, visto que o acompanhamento e tratamento adequados é imprescindível para a preservação da visão e estruturas oculares.
REFERÊNCIAS
1. Tagliari NAB, kelmann RG, Diefenthaler H. Therapeutic aspects of infections causedby Herpes Simplex Virus Type-1. Perspectiva, Erechim. Março/2012. v.36, n.133, p.191-201.
2. Umene K, Sakaoka H. Evolution of herpes simplex virus type 1 under herpesviral evolutionary processes. Arch Virol. 1999;144(4):637–56.
3. Liedtke W, Opalka B, Zimmermann CW, Lignitz E. Age distribution of latent herpes simplex virus 1 and varicella-zoster virus genome in human nervous tissue. J Neurol Sci. 1993;116(1):6–11.
4. Freitas D, Alvarenga L, Lima ALH. Ceratite herpética. Sociedade brasileira de lente de contato e córnea. Arq Bras Oftalmol. 2001;64(1):81-6.
5. Pavan-Lagston D. Diagnosis and Manegement of Herpes Simplex Ocular Infection. Int Ophthalmol Clin. 1975;15(4):19–35.
6. Whittle HC, Smith JS, Kogbe OI, Dossetor J, Duggan M. Severe ulcerative herpes of mouth and eye following measles. Trans R Soc Trop Med Hyg. 1979;73(1):66-9.
7. White ML, Chodosh J. Herpes Simplex Virus Keratittis: A treatment guideline. Department Of Ophthalmology Harvard Medical School. June/2014.
8. Ministério da Sáude, Secretaria de Vigilância em Saúde. Informe semanal Sarampo no Brasil – semanas epidemiológicas 1 a 37, 2020. Informe Nº39. Vol 51, Out 2020. Disponível em: https://antigo.saude.gov.br/images/pdf/2020/October/07/Boletim-epidemiologico-SVS-39--1-.pdf
9. Ministério da Saúde, Guia de vigilância epidemiológica. Secretaria de Vigilância em Saúde, Departamento de Vigilância Epidemiológica. Caderno 2. Sarampo. Brasília 2009; 7ª edição.
10. Kayikçioglu Ö, Kir E, Söyler M, Güler C, Irkeç M. Ocular findings in a measles epidemic among young adults. Ocul Immunol Inflamm. 2000;8(1):59-62.
11. Sandford-Smith JH, Whittle HC. Corneal ulceration following measles in Nigerian children. Br J Ophthalmol. 1979;63(11):720-4.
12. Beckford AI, Kaschula ROC, Stephen C. Factors associated with fatal cases of measles: a retrospective autopsy study. S Afr Med J. 1985:68(12):858-63.
13. Miller DL. Frequency of complications of measles, 1963. Report on a national inquiry by the public health laboratory service in collaboration with the society of medical officers of health. Br Med J. 1964:2(5401):75-8.
14. Morley D. Severe measles in the tropics. I. Br Med J. 1969;1(5639):297-300.
15. Cohrs RJ, Randall J, Smith J, Gilden DH, Dabrowski C, van Der Keyl H, et al. Analysis of individual human trigeminal ganglia for latent herpes simplex type 1 and varicella-zoster virus nucleic acids using real-time PCR. J Virol. 2000;74(24):11464-71.
16. Hill J, Ball M, Neumann D, Azcuy AM, Bhattacharjee PS, Bouhanik S, et al. The high prevalence of herpes simplex virus type 1 DNA in human trigeminal ganglia is not a function of age or gender. J Virol. 2008;82(16):8230-4.
17. Bustos D, Atherton S. Detection of herpes simplex virus type 1 in human ciliary ganglia. Invest Ophthalmol. Vis Sci. 2002;43(7):2244-9.
18. Papanicolau GA, Meyers BR, Fuchs WS, Guillory SL, Mendelson MH, Sheiner P, et al. Infectious ocular complications in orthotopic liver transplant patients. Clin Infect Dis. 1997;24)6):1172-7.
19. Pfefferman R, Gombos G, Kountz S. Ocular complications after renal transplantation. Ann Ophthalmol. 1977;9(4):467-70, 473.
20. Geerlings S, Hoepelman A. Immune dysfunction in patients in patients with Diabetes Mellitus (DM). FEMS Immunol Med Microbiol. 1999;26(3-4):259-65.
21. Ukety TO, Martens K. Ocular ulcerative herpes following measles in Kinshasa, Zaire. Curr Eye Res. 1991;10 Suppl:131-7.
22. Fugier-Vivier I, Servet-Delprat C, Rivailler P, Rissoan MC, Liu YJ, Rabourdin-Combe C. Measles virus suppress cell-mediated immunity by interfering with the survival and functions of dendritic and T cells. J Exp Med. 1997;186(6):813-23.
23. Hodge WG, Margolis T. Herpes simplex virus keratitis among patients who are positive or negative for human immunodeficiency virus: an epidemiologic study. Ophthalmology. 1997;104(1):120-4.
24. Thomas J, Rouse BT. Immunopathogenesis of herpetic ocular disease. Immunol Res. 1997;16(4):375-86.
25. Bennet J, Dolin R, Blaser M. Principles and practice of infectious disease. Vol I. 7a ed. 2009, pp 1642, 1682, 1713. Elsevier.
26. Griffin DE, Ward BJ, Esolen LM. Pathogenesis of Measles Virus Infection: An Hypothesis for Altered Immune Responses. J Infect Dis. 1994;170 Suppl 1:S24-31.
27. Moss WJ, Griffin DE. Measles. Lancet. 2012;379(9811):153–64.
28. Griffin DE. Measles virus-induced suppression of immune responses. Immunol Rev. 2010;236:176–89.
29. Avota E, Gassert E, Schneider-Schaulies S. Measles virus-induced immunosuppression: from effectors to mechanisms. Med Microbiol Immunol. 2010;199(3):227–37.
INFORMAÇÃO DOS AUTORES
Financiamento: Declaram não haver
Conflitos de Interesse: Declaram não haver
Recebido em:
21 de Julho de 2020.
Aceito em:
15 de Dezembro de 2020.