Marcelo C. Ventura Filho1; Liana O. Ventura2; Camila V. Ventura3; Rubens Belfort Jr.4; Mauricio Maia5
DOI: 10.17545/eoftalmo/2018.0001
RESUMO
O vírus da zika (ZIKV), que anteriormente se limitava a casos esporádicos na África e na Ásia, com sintomas similares a uma gripe leve ou subclínica, rapidamente tomou conta das Américas desde 2015 e passou a ter comprovadamente uma relação com microcefalia e outros defeitos congênitos. O amplo espectro das consequências causadas pela infecção intrauterina do feto por ZIKV foi descrito como síndrome congênita do vírus da zika (CZS). Um dos principais pilares desta nova entidade são as manifestações oculares que os recém-nascidos afetados podem apresentar. Curiosamente, todas as crianças com CZS apresentam comprometimento visual significativo, independentemente de apresentarem achados oculares, o que sugere deficiência visual cortical. Além disso, as crianças com CZS podem ter um poder limitado de acomodação, má acuidade visual, altos erros de refração e estrabismo, requerendo frequentemente correção refrativa. Desta forma, a CZS é um desafio não só para as famílias, mas também para os prestadores de cuidados da saúde e para o sistema de saúde pública.
Palavras-chave: Zika Virus; Manifestações Oculares; Deficiência Visual.
ABSTRACT
The emergence of Zika virus (ZIKV), which was previously limited to sporadic cases in Africa and Asia, with subclinical or mild influenza-like illness, has rapidly become widespread in the Americas since 2015, exhibiting a relationship with microcephaly and other birth defects. The broad spectrum of adverse outcomes caused by ZIKV infection in utero has been described as congenital Zika syndrome (CZS). One of the important pillars of this new entity is the ocular manifestations that may be presented at birth by the affected newborns. Interestingly, all infants with CZS show significant visual impairment, regardless of whether they present with ocular findings, which suggests cortical visual impairment. In addition, infants with CZS may have limited power of accommodation, poor visual acuity, high refractive errors, and strabismus, which frequently require refractive correction. Thus, CZS is a challenge not only to families but also to health care providers and the public health system.
Keywords: Zika Virus; Eye Manifestations; Visual Impairment.
RESUMEN
El virus del zika (ZIKV), que previamente se limitaba a casos esporádicos en África y Asia, con síntomas similares a los de una gripe sencilla o subclínica, rápidamente tomó las Américas desde 2015 y se comprobó la relación que pasó a tener con la microcefalia y otros defectos congénitos. El amplio espectro de las consecuencias provocadas por la infección intrauterina del feto por el ZIKV fue descrito como síndrome congénito por el virus del zika (CZS). Uno de los principales pilares de esta nueva entidad son las manifestaciones oculares que los recién nacidos afectados pueden presentar. Lo curioso es que todos los niños infectados por el CZS presentan problemas visuales significativos, ya sea si presentan hallados oculares o no, lo que sugiere deficiencia visual cortical. Además, los niños infectados por el CZS pueden tener un poder limitado de acomodación, mala acuidad visual, elevadores errores de refracción y estrabismo, por lo cual se requiere corrección refractiva frecuente. Así, la CZS presenta un desafío no solamente para las familias, sino también para los prestadores de cuidados de la salud, así como para todo el sistema de salud pública.
Palabras-clave: Virus Zika; Manifestaciones Oculares; Trastornos de la Visión.
INTRODUÇÃO
O vírus da zika (ZIKV) foi primeiramente isolado em 1947, na floresta de Zika, em Uganda, a partir de amostras de um macaco rhesus utilizado como sentinela1. Em 1953, a presença do ZIKV foi detectada em humanos na Nigéria2. No entanto, pelo fato de o quadro clínico da infecção por ZIKV exibir apenas um quadro febril leve, semelhante ao da dengue (DFV) e da chikungunya, o ZIKV recebeu atenção limitada em termos de pesquisa3.
Antes de 2007, apenas casos esporádicos de ZIKV foram relatados na África e Ásia. O primeiro surto documentado de ZIKV foi relatado em 2007 na ilha de Yap, parte dos Estados Federados da Micronésia, resultando em aproximadamente 5.000 infecções numa população total de 6.7004. Seis anos depois, outro surto foi relatado na Polinésia Francesa. envolvendo em torno de 32.000 pessoas5,6. Pela primeira vez, complicações neurológicas, incluindo a síndrome de Guillain-Barré, foram associadas à infecção pelo ZIKV6.
Nas Américas, o ZIKV foi inicialmente identificado no início de 2015 em dois estados do Nordeste do Brasil, Rio Grande do Norte e Bahia7,8. Entretanto, o primeiro estado a reportar defeitos de nascença associados ao vírus da zika foi Pernambuco. Em dezembro de 2015, o Ministério da Saúde do Brasil estimou que 440.000-1.300.000 pessoas haviam sido expostas ao ZIKV no Brasil. Por volta de março de 2016, o vírus tinha se espalhado para pelo menos 33 países e territórios das Américas9-11.
A infecção adquirida por ZIKV é sintomática em apenas 20% da população infectada, sendo febre, erupção cutânea maculopapular, artralgia e conjuntivite não purulenta os principais sintomas4. Seis meses após o início do surto no Brasil, o Ministério da Saúde relatou um aumento do número de recém nascidos com microcefalia12,13.Este evento inesperado espalhou-se rapidamente pelas Américas, o que fez com que a Organização Mundial de Saúde (OMS) declarasse o ZIKV uma emergência internacional de saúde pública durante o período de fevereiro a novembro de 201611.
DIAGNÓSTICO DE INFECÇÃO PELO ZIKV
A infecção por ZIKV é uma doença transmitida por mosquitos e está intimamente relacionada com os vírus da febre amarela, da DFV, do Nilo Ocidental e da encefalite japonesa14. O método mais preciso para diagnosticar a infecção por ZIKV nas mães é a identificação do vírus através do teste de reação em cadeia da polimerase de transcriptase reversa em tempo real (RT-PCR) durante o período de infecção aguda. O vírus é detectável no sangue durante o período de viremia aguda e dos sintomas iniciais e é subsequentemente eliminado na urina, geralmente por 3 a 14 dias15,16. No Brasil, o diagnóstico de infecção por ZIKV complicou-se devido à reatividade cruzada com outros flavivírus, como o DFV, considerado endêmico no Brasil por mais de 30 anos. No entanto, não foram observadas anormalidades congênitas em recém-nascidos de mães que tiveram DFV17.
O diagnóstico da infecção por ZIKV é muito desafiador e exige um enorme esforço da saúde pública, uma vez que a maioria dos casos são assintomáticos18. Pelo fato de o teste RT-PCR para ZIKV não fazer parte do cuidado pré-natal padrão, ele é realizado em gestantes somente quando são relatados sintomas. Isso sugere que a infecção por ZIKV é mais comumente diagnosticada durante os acompanhamentos de ultrassonografia fetal, quando achados neurológicos como calcificações cerebrais e microcefalia são detectados, ou no nascimento, quando outras manifestações clínicas da síndrome congênita do vírus da Zika (SCZV) são encontradas. Nesses casos, é essencial excluir outras causas de microcefalia, incluindo outras infecções congênitas, abuso de álcool e distúrbios genéticos ou familiares. O diagnóstico é confirmado por serologia positiva para o ZIKV (IgM), bem como por testes serológicos negativos para o DFV e o vírus da chikungunya16,18. Em casos duvidosos, testes de neutralização por redução de placa (PRNTs) podem ser realizados para confirmar a SCZV16.
FORMAS DE TRANSMISSÃO DO ZIKV
A forma mais comum de transmissão do ZIKV é através da picada de um mosquito infectado, geralmente A. aegypti ou A. albopictus16. Outras formas de transmissão foram recentemente relatadas na literatura, tais como relações sexuais, transfusão de sangue, transplante de órgãos e, mais significativamente, a transmissão vertical. Além disso, os cientistas recentemente passaram a questionar se o contato com fluidos corporais infectados, como suor, lágrimas e saliva, poderia aumentar o risco de transmissão do vírus19-25.
A transmissão sexual de ZIKV é uma questão importante, uma vez que o RNA viral foi detectado no sêmen 6 meses após o início dos sintomas, o que poderia potencialmente aumentar o risco de transmissão vertical aos fetos20. No entanto, a taxa de transmissão sexual é desconhecida e os fatores de risco para este tipo de transmissão ainda não foram determinados26. Contudo, o uso de preservativos tem sido recomendado em áreas epidêmicas e na presença de sintomas. Se a infecção por ZIKV for diagnosticada por PCR durante a fase aguda, o uso do preservativo é recomendado atualmente por 3-6 meses, para que a transmissão sexual seja evitada; entretanto, são necessários dados adicionais para embasar recomendações definitivas26.
A magnitude do risco de desenvolver microcefalia após a infecção materna permanece desconhecida. Estudos realizados anteriormente no Brasil e na Polinésia Francesa estimaram um risco entre 1- 13% de ter o vírus transmitido ao feto quando a infecção materna ocorre no primeiro trimestre da gestação27-29. Recentemente, um estudo realizado nos Estados Unidos com mulheres grávidas com gestação completa e indícios laboratoriais de uma possível infecção recente por ZIKV revelou que 6% dos seus fetos ou lactentes tinham evidências de defeitos congênitos associados ao ZIKV, principalmente anormalidades cerebrais e microcefalia. Considerando apenas as mulheres com uma possível infecção por ZIKV adquirida exclusivamente durante o primeiro trimestre de gestação, 11% delas tinham um feto ou uma criança com um defeito de nascença30.
A infecção por ZIKV, quando ocorre durante a gravidez, é prejudicial ao feto e está associada à morte fetal, à restrição do crescimento do feto e a um espectro de anormalidades do sistema nervoso central (SNC), o que faz desta doença um problema grave de saúde pública4,27.É por isto que a OMS recomenda às mulheres grávidas não viajarem para áreas endêmicas e às gestantes presentes em tais áreas que usem repelentes para insetos a fim de evitarem as picadas do mosquito hematófago Aedes aegypti. O Centro de Controle e Prevenção de Doenças dos Estados Unidos (CDC) recomenda o teste para ZIKV a todas as mulheres com possível exposição ao vírus durante a gravidez, independentemente de apresentarem ou não sintomas26. As últimas diretrizes do CDC para a avaliação de crianças com uma possível infecção congênita por ZIKV recomendam que a criança seja testada quando houver evidência laboratorial de uma possível infecção materna por ZIKV. Recomendações adicionais indicam a realização de testes em situações em que tenha havido exposição materna à infecção por ZIKV durante a gravidez sem que testes maternos tenham sido realizados, ou quando os resultados dos testes moleculares e serológicos forem negativos, porém realizados fora do período em que se esperaria que esses resultados fossem positivos26.
ACHADOS CLÍNICOS
A relação de causalidade entre a infecção por ZIKV e as malformações estruturais neonatais foi recentemente demonstrada31. Cugola et al. analisaram a cepa brasileira do ZIKV (ZIKV-BR) em modelos experimentais com camundongos e relataram que o vírus atravessa a barreira placentária, causando microcefalia, visando células progenitoras corticais e induzindo a morte celular através de apoptose e autofagia, prejudicando assim o desenvolvimento neurológico32. A microcefalia é uma doença grave do desenvolvimento cerebral fetal que resulta em um tamanho de cabeça menor do que o normal e é frequentemente acompanhada por atrasos no desenvolvimento cognitivo e físico. Causas genéticas ou ambientais de dano no cérebro fetal pode resultar em microcefalia congênita e já foram bem estabelecidas associações também com causas infecciosas (por exemplo, rubéola, infecção por citomegalovírus e toxoplasmose)31. A microcefalia é apenas um dos possíveis resultados adversos entre um espectro de condições que podem fazer parte da SCZV33. O padrão reconhecível da CZS pode incluir: (1) microcefalia grave com colapso parcial do crânio; (2) córtex cerebral fino com calcificações subcorticais; (3) cicatrização macular e pigmentação mosqueada focal da retina; (4) contraturas congênitas; e (5) hipertonia precoce acentuada com sintomas de envolvimento extrapiramidal33.
Alguns estudos relataram que os bebês normocefálicos com SCZV ao nascimento apresentam um desenvolvimento cerebral pós-natal anormal ou efeitos adversos que não são imediatamente evidentes no nascimento34.
ACHADOS OCULARES
Esta nova entidade foi relatada como causadora de anomalias cerebrais e manifestações oculares nos olhos dos recém-nascidos afetados35-39. Pesquisadores da Fundação Altino Ventura, em Recife, Brasil, organizaram uma força-tarefa multidisciplinar em parceria com pesquisadores da Universidade Federal de São Paulo (Unifesp) e do Hospital Universitário Oswaldo Cruz (HUOC) para investigar os efeitos visuais e neurológicos da infecção pelo ZIKV. Na primeira força-tarefa, convocada em 14 de dezembro de 2015, 55 recém-nascidos foram examinados, dos quais 40 apresentaram microcefalia, outras manifestações neurológicas e serologia negativa para outras doenças infecciosas congênitas38. Neste estudo, manifestações oculares foram detectadas em 55,6% dos recém-nascidos, incluindo cicatrizes coriorretinianas, pigmentação mosqueada na região macular, hipoplasia do nervo óptico, palidez do nervo óptico e relação copo/disco aumentada31. Curiosamente, uma situação semelhante ocorreu em Salvador, na Bahia, onde achados oculares similares foram relatados em 34,5% dos recém-nascidos afetados37. É importante enfatizar que, naquela época, não havia serologia para ZIKV disponível no Brasil. Assim, um diagnóstico presumido de SCZV foi dado a esses recém-nascidos em Recife e Salvador. Esse mesmo estudo relatou que o feto infectado é provavelmente mais suscetível aos efeitos do vírus no olho durante o primeiro trimestre da gestação, de forma semelhante a outras infecções congênitas38. Além disso, o estudo demonstrou que a gravidade da microcefalia está também associada a anormalidades do fundo ocular.
Um estudo posterior de Ventura et al. revelou que, independentemente do envolvimento do fundo ocular, todas as crianças com SCZV apresentam deficiência visual. Isto sugere que tal deficiência está muito provavelmente associada aos danos extensos ao SNC40. Esta hipótese é apoiada por vários estudos de modelos em camundongos, que mostram que o ZIKV ataca severamente as células progenitoras neurais, causando morte celular e restringindo o desenvolvimento neurológico32,41-43.
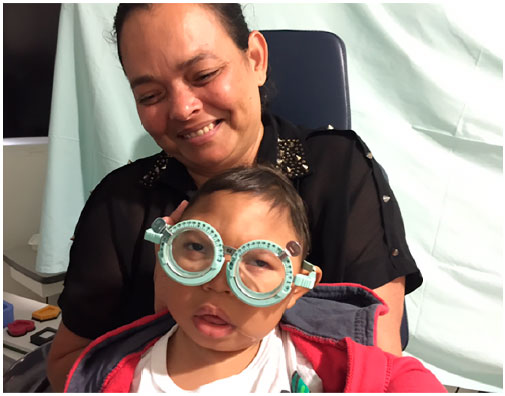
As crianças com SCZV, de forma semelhante a outros bebês com anormalidades cerebrais e deficiência visual neurológica, podem ter um poder de acomodação limitado, má acuidade visual, altos erros de refração e estrabismo44-46. A supercorreção feita para melhorar a acomodação resultou em melhora imediata da visão binocular em 62% das crianças (Figura 1)44.
Uma vez que a infecção por ZIKV é uma doença emergente, um maior número de estudos faz-se necessário para que essa infecção seja melhor investigada. Estudos anteriores destacaram como sequelas comuns de longo prazo associadas a infecções virais congênitas: perda auditiva, deficiência visual e anormalidades neuromusculares e de desenvolvimento neurológico33,47.
CONCLUSÕES
Ainfecção por ZIKV surgiu recentemente como uma grande ameaça global para as mulheres gestantes. Dadas as graves malformações congênitas causadas pelo vírus e as consequências substanciais de longo prazo, incluindo convulsões, deficiências visuais e auditivas, dificuldades de alimentação e atraso significativo no desenvolvimento, torna-se necessário uma rápida e contundente resposta de saúde pública em nível mundial para limitar e prevenir o grande impacto social, econômico e principalmente na saúde que o vírus acarreta, e também para promover o desenvolvimento de tratamentos, vacinas e diagnósticos aprimorados. Todos os recém-nascidos suspeitos de infecção por ZIKV devem ser submetidos, pelo menos, a um exame oftalmológico, incluindo o exame de fundo de olho sob midríase, bem como avaliação auditiva e global. O monitoramento longitudinal das crianças com a SCZV é essencial para uma caracterização completa dos resultados visuais e sistêmicos. O potencial pandêmico da doença requer pesquisas para o desenvolvimento de uma vacina e maiores esforços no controle dos vetores da doença.
REFERÊNCIAS
1. Dick GW, Kitchen SF, Haddow AJ. Vírus da zika. I. Isolamentos e especificidade serológica. Trans R Soc Trop Med Hyg. 1952;46:509-20.
2. MacNamara FN. Vírus da zika: um relatório sobre três casos de infecção humana durante uma epidemia de icterícia na Nigéria. Trans R Soc Trop Med Hyg.1954;48:139-45.
3. Musso, D, Cao-Lormeau, VM, and Gubler, DJ. Vírus da zika: seguindo o caminho da dengue e chikungunya? Lancet. 2015;386:243-4.
4. Duffy MR, Chen T-H, Hancock WT, et al. Surto do vírus da zika na ilha de Yap, Estados Federados da Micronésia. N Engl J Med. 2009;360:2536-43.
5. Cao-Lormeau VM, Roche C, Teissier A, et al. Vírus da zika, Polinésia Francesa, Pacífico Sul, 2013. Emerg Infec Dis. 2014;20:1085-6.
6. Avaliação rápida do risco: Surto de infecção pelo vírus da zika, Polinésia Francesa. Estocolmo: Centro Europeu para Prevenção e Controle da Doença, 14 de fevereiro de 2014 Disponível em: http://ecdc.europa.eu/en/publications/Publications/Zika-virus-French-Polynesia-rapid-risk-assessment.pdf Último acesso: 14 de dezembro de 2017.
7. Zanluca C, Melo VC, Mosimann AL, Santos GI, Santos CN, Luz K. Primeiro relatório de transmissão autóctone do vírus da zika no Brasil. Mem Inst Oswaldo Cruz. 2015;110:569-72.
8. Campos GS, Bandeira AC, Sardi SI. Surto do vírus da zika, Bahia, Brasil. Emerg Infec Dis. 2015;21(10):1885-6.
9. Surtos do vírus da zika nas Américas. Wkly Epidemiol Rec. 2015;90:609-610
10. Centro Europeu para Prevenção e Controle de Doenças. Avaliação rápida do risco: Epidemia do vírus da zika nas Américas: potencial associação com microcefalia e Síndrome de Guillain-Barré. 10 de Dezembro de 2015. Disponível em: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/zika-virus-americas-association-with-microcephaly-rapid-risk-assessment.pdf- Último acesso: 14 de dezembro de 2017.
11. Organização Mundial da Saúde (OMS). Microcefalia e Síndrome de Guillain-Barré pelo vírus da zika. Relatório da situação. 17 de março de 2016. Disponível em: http://apps.who.int/iris/bitstream/10665/204633/1/zikasitrep_17Mar2016_eng.pdf Último acesso: 14 de dezembro de 2017.
12. Possível associação entre infecção pelo vírus da zika e microcefalia — Brasil, 2015. MMWR Morb Mortal Wkly Rep. 2016;65:59-62.
13. Victora CG, Schuler-Faccini L, Matijasevich A, Ribeiro E, Pessoa A, Barros FC. Microcefalia no Brasil: como interpretar os números relatados? Lancet. 2016;387:621-4
14. Oliveira Melo AS, Malinger G, Ximenes R, Szejnfeld PO, Alves Sampaio S, Bispo de Filippis AM. Infecção intrauterina pelo vírus da zika causa anormalidade cerebral e microcefalia no feto: ponta do iceberg? Ultrasound Obstet Gynecol. 2016;47:6-7.
15. Gourinat AC, O'Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detecção do vírus da zika na urina. Emerg Infec Dis. 2015;21:84-6.
16. Pinto Junior VL, Luz K, Parreira R, Ferrinho P. Vírus da zika: uma revisão para os médicos. Acta Med Port. 2015;28(6):760-5.
17. Castanha PM, Cordeiro MT, Martelli CM, Souza WV, Marques ET Jr, Braga C. Força de infecção dos serotipos da dengue em um estudo baseado na população do Nordeste do Brasil. Epidemiol Infect. 2013;141:1080-8.
18. Centro para Controle e Prevenção de Doenças. Guia de testes para infecção pelo vírus da zika para laboratórios dos E.U.A.. Atualizado em 24 de julho de 2017. Disponível em: https://www.cdc.gov/zika/laboratories/lab-guidance.html Acessado em 5 de fevereiro de 2018.
19. Centro para Controle e Prevenção da Doença. Transmissão e riscos. http://www.cdc.gov/zika/transmission/index.html. Acessado em 01 de agosto de 2016.
20. Turmel JM, Abgueguen P, Hubert B, et al. Transmissão sexual tardia do vírus da zika relacionada à persistência no sêmen. Lancet. 2016;387(10037):2501.
21. Infecção pelo vírus da zika e transplante de órgãos sólidos: um novo desafio. Am J Transplant 2016 doi: 10.1111/ajt.14047.
22. Motta IJF, Spencer BR, Cordeiro da Silva SG, et al. Evidência para transmissão do vírus da zika por transfusão de plaquetas. N Engl J Med 2016; 375:1101- 3.
23. de Araújo TVB, Rodrigues LC, de Alencar Ximenes RA, et al. Associação entre infecção pelo vírus da zika e microcefalia no Brasil de janeiro a maio de 2016: relatório preliminar de um estudo de caso com controle. Lancet Infect Dis. 2016;16(12):1356-63.
24. Miner JJ, Sene A, Richner JM, et al. Infecção pelo vírus da zika em camundongos causa panuveíte com eliminação do vírus nas lágrimas. Cell Rep 2016;16(12):3208-18.
25. Bingham AM, Cone M, Mock V, et al. Comparação dos resultados de testes para RNA do vírus da zika em amostras de urina, soro e saliva de pessoas com doença do vírus da zika associada a viagens - Flórida, 2016. MMWR Morb Mortal Wkly Rep 2016;65(18):475-8.
26. Russell K, Oliver SE, Lewis L, et al. Atualização: Orientações provisórias para a avaliação e o gerenciamento de crianças com possível infecção congênita pelo vírus da zika—Estados Unidos, agosto 2016. MMWR Morb Mortal Wkly Rep. 2016;65(33):870-8.
27. Brasil P, Pereira JP Jr, Moreira ME, Ribeiro Nogueira RM, Damasceno L, Wakimoto M, et al. Infecção pelo vírus da zika em mulheres grávidas no Rio de Janeiro. N Engl J Med. 2016;375(24):2321-34.
28. Cauchemez S, Besnard M, Bompard P, et al. Associação entre o vírus da zika e microcefalia na Polinésia Francesa, 2013-15: um estudo retrospectivo. Lancet. 2016;387(10033):2125-32.
29. Johansson MA, Mier-y-Teran-Romero L, Reefhuis J, Gilboa SM, Hills SL. Zika e o risco de microcefalia. N Engl J Med. 2016;375(1):1-4.
30. Honein MA, Dawson AL, Petersen EE, et al. Defeitos de nascença entre fetos e recém-nascidos de mulheres norte-americanas com evidência de possível infecção pelo vírus da zika durante a gestação. JAMA. 2017;317(1):59-68.
31. Rasmussen SA, Jamieson DJ, Honein MA, Peterson LR. Vírus da zika e defeitos congênitos – revisão da evidência de causalidade. N Engl J Med. 2016;374:1981-7.
32. Cugola FR, Fernandes IR, Russo FB, et al. A cepa brasileira do vírus da zika causa defeitos de nascença em modelos experimentais. Nature. 2016;534:267- 71
33. Moore CA, Staples JE, Dobyns WB, et al. Caracterizando o padrão de anomalias na síndrome congênita do vírus da zika para médicos pediatras. JAMA Pediatr. 2017;171(3):288-95.
34. Van der Linden V, Pessoa A, Dobyns W, et al. Descrição de 13 crianças nascidas no período de outubro de 2015 a janeiro de 2016 com infecção congênita pelo vírus da zika sem microcefalia ao nascimento - Brasil. MMWR Morb Mortal Wkly Rep. 2016;65:1343-8.
35. Ventura CV, Maia M, Bravo-Filho V, Góis AL, Belfort Jr R. Vírus da zika no Brasil e atrofia macular em uma criança com microcefalia. Lancet. 2016;387(10015):228.
36. Ventura CV, Maia M, Ventura BV, et al. Achados oftalmológicos em crianças com microcefalia e infecção intra-uterina presumida pelo vírus da zika. Arq Bras Oftalmol. 2016;79:1-3.
37. de Paula Freitas B, de Oliveira Dias JR, Prazeres J, et al. Achados oculares em crianças com microcefalia associada a infecção congênita presumida pelo vírus da zika em Salvador, Brasil. JAMA Ophthalmol. 2016 Feb 9. doi: 10.1001/jamaophthalmol.2016.0267.
38. Ventura CV, Maia M, Travassos SB, et al. Fatores de risco associados a achados oftalmoscópicos identificados em crianças com infecção congênita presumida pelo vírus da zika. JAMA Ophthalmol. 2016; 134(8):912-8.
39. Miranda HA II, Costa MC, Frazão MA, Simão N, Franchischini S, Moshfeghi DM. Espectro expandido de achados oculares congênitos em casos de microcefalia com infecção presumida pelo vírus da zika. Ophthalmology. 2016;123(8):1788-94.
40. Ventura LO, Ventura CV, Lawrence L, et al. Deficiência visual em crianças com síndrome congênita do vírus da zika. J AAPOS. 2017;21:295-299.e2.
41. Li C, Xu D, Ye Q, et al. O vírus da zika interrompe o desenvolvimento do progenitor neural e leva à microcefalia em camundongos. Cell Stem Cell. 2016;19:120-6.
42. Wu K, Zuo G, Li X, et al. A transmissão vertical do vírus da zika visando as células gliais radiais afeta o desenvolvimento do córtex de camundongos descendentes. Cell Res. 2016;26:645-54.
43. Van der Pol AN, Mao G, Yang Y, Ornaghi S, Davis JN. Alvos do vírus da zika no cérebro em desenvolvimento. J. Neurosci. 2017;37:2161-75.
44. Ventura LO, Lawrence L, Ventura CV, et al. Resposta à correção de erros de refração e hipoacomodação em crianças com síndrome congênita do vírus da zika. J AAPOS. 2017;21(6):480-4.
45. Jacobson L, Ygge J, Flodmark O, Ek U. Características visuais e perceptivas, mobilidade ocular e estrabismo em crianças com leucomalácia periventricular. Strabismus 2002;10:179-83.
46. Guzzetta A, Mercuri E, Cioni G. Transtornos visuais em crianças com lesões cerebrais: 2. Deficiência visual associada a paralisia cerebral. Eur J Paediatr Neurol 2001;5:115-9.
47. Leal MC, Muniz LF, Ferreira TS, et al. Perda auditiva em crianças com microcefalia e evidência de infecção congênita pelo vírus da zika - Brasil, novembro de 2015 – maio de 2016. MMWR Morb Mortal Wkly Rep. 2016:65(34):917-9.
Fonte de financiamento: declaram não haver.
Parecer CEP: não aplicável.
Conflito de interesses: declaram não haver.
Recebido em:
20 de Dezembro de 2017.
Aceito em:
15 de Fevereiro de 2018.