Mauricio Maia1; Juliana Moura Bastos Prazeres2; Michel Eid Farah3; Eduardo Rodrigues4; André Maia5
DOI: 10.17545/e-oftalmo.cbo/2015.38
RESUMO
OBJETIVOS: Discutir o conhecimento sobre o uso de corantes vitais em cirurgias de vitrectomia e fornecer algumas recomendações com o objetivo de minimizar os riscos associados à toxicidade.
MÉTODOS: foi realizada uma revisão da literatura com o objetivo de integrar e compilar artigos disponíveis sobre cromovitrectomia.Foi feita uma análise dos artigos e descrição das indicações clínicas, técnicas de aplicação assim como aspectos como toxicidade e perfil de segurança dos principais corantes vitais utilizados cirurgias de vitrectomia posterior.
RESULTADOS: A Triancinolona acetonida é “padrão ouro” para identificação do vítreo da base e da hialoide posterior; deve ser utilizado 0.3 mL em uma concentração de 40mg/mL e sem álcool benzílico em sua composição. O Azul Tripan é o corante ideal para identificação de MER; deve ser utilizado 0.2-0/3mL do corante em uma concentração de 1.2-1.5mg/ml. O Azul Brilhante é o corante ideal para identificação de MLI; deve ser utilizado 0.2-0.3mL do corante em uma concentração de 0.25mg/mL. Outros corantes naturais estão sendo estudados em cromovitrectomia.
CONCLUSÃO: Esse artigo descreve propriedades, técnicas de aplicação , indicações e toxicidade retiniana dos principais corantes vitais descritos na literatura. A cromovitrectomia representa uma área de pesquisa em expansão e novos corantes estão em desenvolvimento.
Palavras-chave: Vitrectomia. Cromovitrectomia
1. INTRODUÇÃO
Cromovitrectomia é a aplicação de corantes vitais para auxiliar a visualização de tecidos pré-retinianos durante cirurgias vitreorretinianas. A técnica foi introduzida com o objetivo de minimizar complicações relacionadas ao peeling de membrana limitante interna (MLI), remoção insatisfatória do vítreo e remoção incompleta de membrana epirretiniana (MER). Desde 2000, cirurgiões vitreorretinianos utilizam amplamente corantes vitais durante cirurgias de vitrectomia.1,2 Aindocianina verde (ICV), primeiro corante vital utilizado em cromovitrectomia, facilita a identificação da fina e transparente MLI. Em seguida, o azul tripan (AT) foi identificado como um agente apropriado para identificar membrana epirretiniana (MER) e a triancinolona (TA) como um bom agente para corar o vítreo. Recentemente, outros corantes como infracianina verde (IfCV) e azul patente (AP) foram propostos para uso em cirurgias de vitrectomia.3A seguir, será discutido o conhecimento sobre o uso de corantes em cirurgias de vitrectomia e serão dadas algumas recomendações com o objetivo de minimizar os riscos associados à toxicidade.
2. CORANTES VITAIS PARA MLI
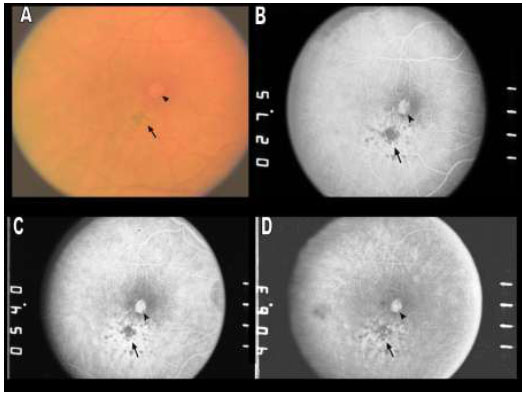
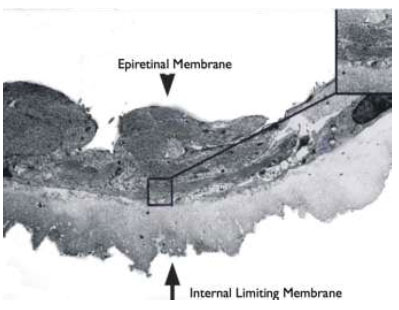
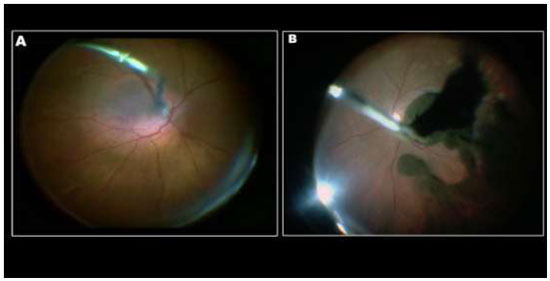
A remoção da MLI para tratamento de buraco macular idiopático (BM) foi descrita pela primeira vez por Eckardt e colaboradores em 1997.Uma ampla metanálise de estudos não randomizados envolvendo 1.654 olhos, sugere que o peeling de MLI aumenta as taxas de sucesso anatômico e funcional em casos de vitrectomia por buraco macular idiopático(Figura 1).4Entretanto, a remoção cirúrgica pode levar a danos retinianos pois a MLI é uma estrutura intraocular de 10 micrômetros de espessura de difícil visualização sem o auxílio de corantes.(Figura 2)As duas principais complicações associadas ao peeling de MLI são defeitos de campo visual e dano ao epitélio pigmentado da retina (EPR). Defeitos de campo visual temporal à mácula podem estar relacionados a trauma mecânico ao disco óptico, a dano no momento da troca fluído-ar ou trauma direto à retina.(Figura 1A)Achados de hiperpigmentaçãoretiniana em região macular ou hipofluorescência na angiografia podem ter sido causados por trauma cirúrgico ou fototoxicidade.3Com o objetivo de minimizar complicações relacionadas a trauma cirúrgico e fototoxicidade descreveremos os corantes vitais mais utilizados.
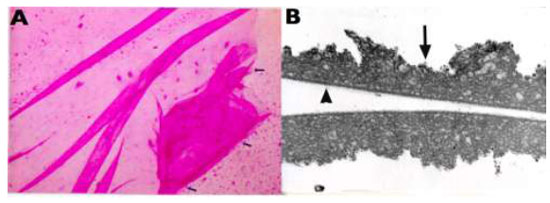
2.1. Indocianina Verde
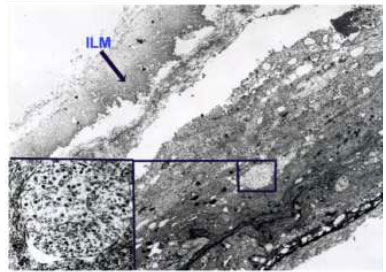
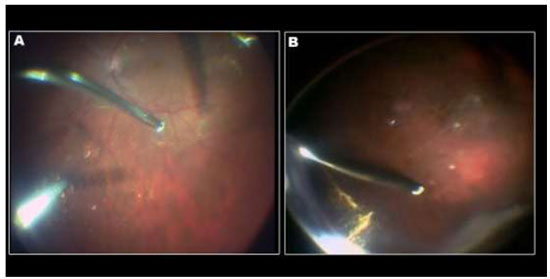
A aplicação de ICV foi descrita pela primeira vez em olhos cadavéricos para promover melhor visualização da MLI. Desde então, vários artigos foram publicados sobre o uso de ICV como um adjuvante cirúrgico na identificação e remoção de MLI em cirurgias maculares. (Figuras 3 e 7A)
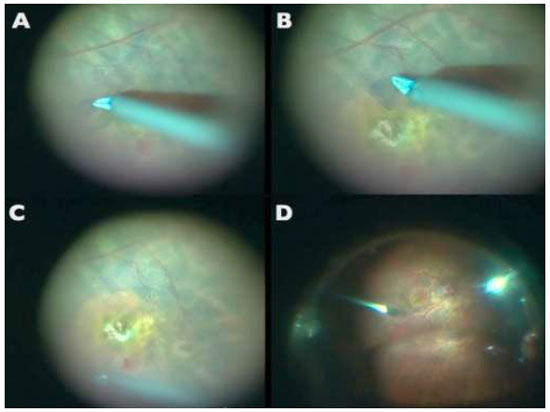
A ICV adere bem a componentes da matriz extracelular como colágeno tipo 4, laminina e fibronectina.-Em modelos porcinos, quando exposta à luz, a ICV produz um aumento significante na rigidez biomecánica, facilitando o peeling de MLI.6Diversos autores reportaram uma maior facilidade na realização do procedimento e menor trauma cirúrgico quando utilizam a ICV. É possível obter sucesso anatômico pós cirúrgia de BM de 74% a 100% dos casos em que o peeling foi guiado por ICV.3,4,5,6,7
Entretanto, estudos sugerem potencial efeito tóxico à retina com o uso de ICV.8,9,10 A ICV pode persistir após cirurgia de buraco macular por até 36 meses.3 Além disso, a ICV pode migrar para o espaço sub-retiniano através do buraco macular e causar dano retiniano.11,12,13 Complicações da cromovitrectomia assistida por ICV incluem: alterações no EPR, defeitos de campo visual e atrofia do nervo óptico.3,14
Foram realizados poucos estudos controlados para comparar a remoção da MLI assistida por ICV com a remoção não assistida de corantes vitais. Alguns autores encontraram piores resultados de acuidade visual quandoutilizaram ICV.15,16,17 Melhores resultados em publicações recentes podem ser explicados por um aprimoramento na técnica de injeção de ICV.3,18
O uso inicial de ICV em cirurgias de BM foi com uma concentração de 0.5%. Após a constatação de alterações de EPR e danos no campo visual, acredita-se que seja mais seguro utilizar ICV em concentrações menores.Em estudo realizado com concentrações menores (0.125%) não foram verificados sinais de toxicidade retiniana, com bons resultados anatômicos e funcionais após cirurgia.19 Entretanto, Engelbrecht e colaboradores,usando a mesma concentração de ICV observaram alterações no EPR em 54.5% dos casos.20 A diferença pode ser devido à osmolaridade da solução, que era 299mOsm e 250mOsm respectivamente. Nossa equipe de pesquisa observou anormalidades no EPR em 27.5% dos casos após aplicação de ICV com concentração de 5mg/ml e osmolaridade de 270mOsm. (Figura 4) Estudos recentes têm utilizado ICV na concentração de 0.05% e osmolaridade de cerca de 290mOsm com poucos ou nenhum sinal de dano ao EPR.3 Uma metanálise sobre o uso da ICV em cirurgias vitreorretinianas, analisando 837 olhos, mostrou resultados anatômicos semelhantes a outros corantes, porém, com piores resultados funcionais.21 A maioria dos estudos que compõem esta metanálise utilizou ICV em altas concentrações e volumes.
A ICV tem sido utilizada para facilitar a visualização e remoção da MLI em outras doenças. O uso em casos de edema macular diabético (EMD) não mostrou sinais de toxicidade retiniana, no entanto, o resultado visual foi semelhante a casos em que não foi utilizada a ICV.22 Não houve diferenças também em termos de acuidade visual entre o grupo que utilizou ICV e TA em pacientes com edema diabético difuso.21 Radetzky e colaboradores avaliaram também o peeling de MLI assistido por ICV para edema macular persistente após oclusão de veia central da retina, EMC, síndrome de Irvine-Gass e tração vitreomacular. Melhora significativa da visão só foi observada em pacientes com edema macular diabético.24
2.2 Infracianina Verde
A Infracianina Verde (IfCV) é a porção modificada da ICV que não contém 5% de iodeto de sódio. A IfCV cora a MLI homogeneamente, mas não cora membranas epirretinianas. Semelhante a ICV, este corante sem iodo na sua composição, também tem alta afinidade com a MLI e facilita sua visualização. A diluição da IfCV em glicose 5% gera uma solução isosmótica (294 - 314mmmol/kg), reduzindo, dessa forma, os riscos de toxicidade. Estudos clínicos mostraram poucos ou nenhum sinal de toxicidade com a aplicação intravítrea de IfCV. As taxas de fechamento de BM na cirurgia utilizando IfCV ultrapassam 90%. 25,26 Em casos de remoção de MLI em pacientes com EMD, esta se mostrou segura e com bons resultados cirúrgicos.27 No entanto, estudos clínicos controlados mostraram que o peeling de MLI assistido por IfCV não melhorou significativamente os resultados da cirurgia de BM.7,28
Análises imunohistoquímicas de MLI retiradas utilizando IfCV mostraram a presença de remanescentes dos podócitos das células de Muller, células da glia e células ganglionares.29 Isso pode ser explicado por estudo realizado em modelos cadavéricos que verificou que, quando submetidas a iluminação, a IfCV e ICV podem alterar o plano de clivagem da MLI.30 Assim, apesar de IfCV e ICV facilitarem a remoção da MLI, podem produzir alterações indesejadas na retina neurosensorial, EPR e levar a defeitos de campo visual.32,31
2.3. Azul Brilhante
Azul Brilhante (AB) é um corante sintético, utilizado em cromovitrectomia devido a seu perfil de segurança. Foi verificado em estudo prévio que não causa alterações significativas na retina quando utilizado em baixas concentrações como 0,5mg/mL para realização de peeling de MLI em primatas.32
Em humanos, uma solução isosmolar de 0.25mg/mL de AB cora adequadamente a MLI quando utilizado em cirurgias para tratamento de membrana epirretiniana idiopática e buraco macular. 85% dos olhos melhoraram pelo menos 2 linhas na tabela de Snellen, sem sinais de toxicidade.33 A avaliação com ERG multifocal também não evidenciou toxicidade retiniana.34 Apesar de não corar adequadamente a MER, é possível sua remoção, uma vez que esse corante tem boa afinidade com a MLI e possibilita corar regiões onde não existem MER e realizar aressecção em bloco de ambas as membranas. Essa técnica pode levar à redução da recorrência de MER.35
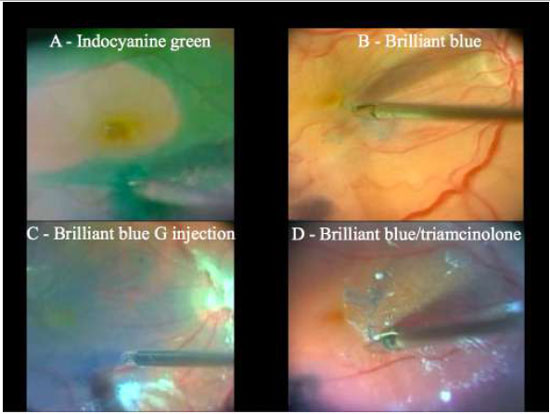
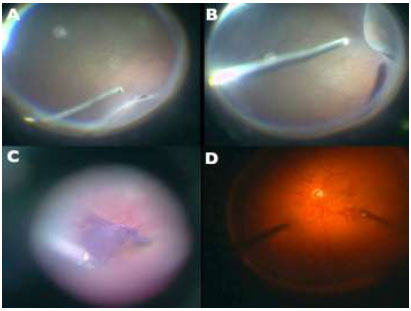
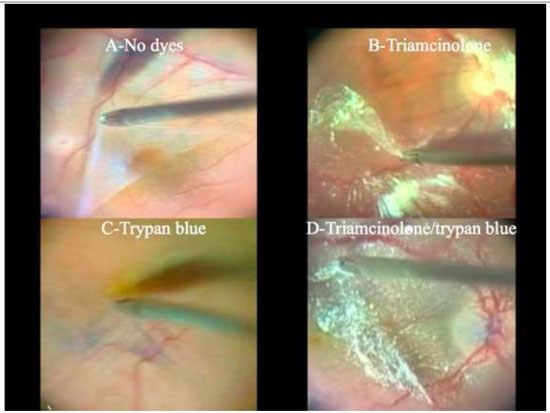
Devido a alta afinidade com a MLI, o AB é uma boa alternativa à ICV e IfCV. (Figuras 5 e 7B)Estudos que avaliaram toxicidade ao EPR evidenciaram menores efeitos tóxicos quando comparados com ICV.36 Além disso, a combinação de novos filtros, como o filtro ambar do StellarisPCTM(Bausch&Lomb, USA), em combinação com AB, resulta em um alto contraste e excelente visualização da MLI. (Chow, D. VailVitrectomy Meeting 2013)(Figura 6).
2.4. Triancinolona acetonida (TA)
Kimura e colaboradores utilizaram a TA pela primeira vez para realização de peeling de MLI. Demonstraram que os cristais se depositavam na superfície da MLI, facilitando sua identificação e remoção, com bons resultados anatômicos e funcionais em 3 meses. Estudos demonstraram a presença de MLI em espécimes após remoção assistida por TA, mostrando que é possível remover a MLI e não apenas o vítreo utilizando essa substância.2,7Outros autores confirmaram que a remoção da MLI assistida sugere que o uso da TA tem o mesmo resultado anatômico com melhores resultados visuais e ausência de efeitos colaterais.39
Foram detectados cristais de TA por até 40 dias após cirurgia de vitrectomia posterior devido a BM. Alguns autores sugerem que essa persistência dos cristais de triancinolona pode atrasar o processo de cicatrização e o fechamento do BM.3 Em estudo comparativo, foi avaliada a realização do peeling de MLI com e sem triancinolona. Durante um período de seguimento de 7.3 meses não foi observada recorrência do BM.37 A preferência para uso em cromovitrectomia deve ser por triancinolona sem preservantes.40
2.5. Azul Tripan
Logo após a introdução do azul tripan (AT) na cirurgia de catarata, ele foi proposto como corante em cromovitrectomia.3No entanto, AT não facilita a visualização da MLI como a ICV, tornando a remoção da MLI mais difícil do que quando utilizada a ICV.2,41 Quando utilizado com o objetivo de corar a MLI, o AT deve ser mantido em contato com a MLI por um período superior do que a ICV.
Dois estudos comparativos mostraram a mesma taxa de fechamento de BM quando utilizado AT ou ICV para tratamento de BM idiopático grau II - IV.Entretanto, a visão foi significativamente melhor no grupo que utilizou AT.41,42
Apesar da maioria dos estudos evidenciar que AT exerce pouco ou nenhum efeito tóxico na retina, este pode causar dano retiniano se utilizado em altas concentrações.3,43,44 Futuros estudos devem investigar mais profundamente a associação do azul tripan com outros corantes em cromovitrectomia e elucidar a dose ideal para utilização combinada.45
2.6. Resumo de técnicas de remoção de MLI
A técnica de remoção da MLI é uma manobra cirúrgica difícil e muito útil para o manejo de diversas doenças vitreorretinianas. Nos dias atuais a cromovitrectomia é ferramenta fundamental na realização desse procedimento cirúrgico, trazendo maior efetividade e segurança. (Figura7e Tabela 1):A- Indocianina Verde ou Infracianina Verde (menor perfil de toxicidade); B- Azul Brilhante - utilizado como “padrão ouro” para este procedimento; C-Azul Brilhante G (não requer injeção vigorosa devido à alta densidade) e D-Cristais de Triancinolona + azul brilhante.
3 CORANTES VITAIS PARA MEMBRANA EPIRRETINIANA
3.1. Azul Tripan
A Membrana epirretiniana está relacionada com proliferação glial devido a microroturas da MLI resultando em proliferação de colágeno, astrócitos e células da glia.(Figura8) O AT é comumente utilizado em microscopia celular e na década de 90 foi verificada sua afinidade com a cápsula anterior do cristalino. Mais tarde, o AT foi utilizado em cromovitrectomia para corar tecidos pré-retinianos como MLI e MER. Esse corante vital atravessa membranas celulares apenas de células mortas, colorindo-as de azul. Células e tecidos com membranas celulares intactas não coram com essa substância, uma vez que o transporte seletivo através das membranas celulares não permite a ligação do AT. Assim, essa substância apresenta uma forte afinidade por MER devido à grande quantidade de células da gliadesvitalizadas.(Figura9)7Diversos investigadoresconcordam que o AT é indicado para reconhecimento de MER em cromovitrectomia.7A utilização desse corante vital para facilitar a identificação e extensão da MER minimiza traumas mecânicos para a retina durante o procedimenopeeling(Figura10C).
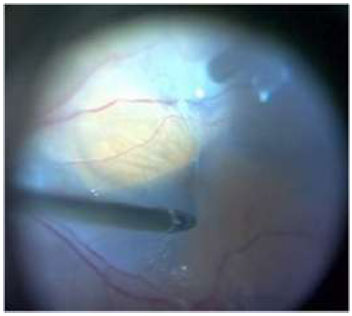
Estudo realizado em 20 pacientes com MER(pucker macular), não evidenciou diferença estatisticamente significante na acuidade visual pós-operatóriaapós remoção de MER utilizando ou não AT 0.15% (período de 4 a 6 meses). Entretanto, 4 de 10 pacientes que não utilizaram o corante e 7 de 10 pacientes que utilizaram melhoraram a acuidade visual em 2 linhas ou mais.43 Um estudo comparativo com AT e ICV para remoção de MER também apresentou resultados favoráveis ao uso de AT.46
Os estudos não evidenciam sinais de toxicidade retiniana ou defeitos no EPR utilizando AT. Entretanto, em um relato de caso de migração do AT para o espaço sub-retiniano, em um sítio distante da fóvea, foram verificadas alterações a nível do EPR.47 Análises histopatológicas das amostras de MER não mostram células no lado retiniano da amostra nem sinais de apoptose celular48 e o ERG multifocal não indica toxicidade.49 Estudos com microscopia electrónica das amostras de MER coradas com AT mostram fragmentos de MLI.46 Entretando, Smiddy e colaboradores mostraram que, mesmo sem uso de nenhum corante, as espécimes de MER contêm fragmentos de MLI em 76% dos casos.3A relevância clínica desses achados ainda deve ser elucidada e futuros estudos controlados devem determinar se o AT pode ter alguma toxicicidade.
Para aumentar a penetração do corante na superfície retiniana pode ser realizada uma troca fluído-ar e o AT pode ser misturado com glicose, criando uma solução mais densa que a água.(Figura9, Tabela 1) LesnikOberstein e colaboradores usaram AT e glicose a 10% isovolumetricamente e com uma osmolaridade de 320mOsm/L para avaliar a afinidade do corante sem a realização de troca fluído-ar.50 Apenas 25% dos olhos necessitaram de uma reaplicação do corante para melhor visualização da MER. Além disso, todos os pacientes apresentaram melhora da acuidade visual sem sinais de toxicidade retiniana. No entanto, é importante lembrar quealtas concentrações de glicose devem ser evitadas. A injeção de 0.05ml de uma solução com 1000mOsm em animais causou palidez de retina seguido de descolamento de retina e degeneração retiniana permanente. O ERG mostrou imediata perda da onda c e um declínio mais lento da onda a e b.51,52A osmolaridade deve ser considerada sempre que for aplicada qualquer droga ou corante intravítreo. Em resumo, o AT pode ser misturado com glicose para obtenção de uma solução mais densa com direcionamento mais eficaz para o polo posterior, no entanto, deve ser misturado apenas com glicose a 5-10% (25% do corante e 75% de glicose).18(Tabela 1)
3.2. Azul patente, azul de bromofenol e indocianina verde
Esses corantes não são comumente utilizados em cromovitrectomia para identificação de MER. No entanto, a literatura mostra que, em algumas situações, eles podem ser utilizados na técnica de remoção de MER.
3.2.1. Azul Patente
AP é um marcador fluorescente que permite a remoção de linfonodos e identificação de espécimes fúngicas in vitro. A substância foi identificada como corante para cápsula anterior do cristalino em uma concentração de 0.24%.3
Estudos em animais e dados clínicos preliminares demonstraram afinidade moderada desse corante com o vítreo e MER e afinidade fraca com a MLI.2,7No entanto, outros estudos revelam que o AP é um marcador tão apropriado quanto o AT para MER.53
Os dados relativos à toxicidade do AP são conflitantes. Em um estudo, AP causou toxicidade leve e reversível às celulas retinianas,54 enquanto células do EPR expostas a AP invitro não mostraram sinais de toxicidade.53
Nosso estudo experimental em coelhos avaliou a toxicidade após injeção subretiniana de AP. Foram evidenciados apenas danos leves ao tecido retiniano durante o período de seguimento; os danos histológicos induzidos pelo AT foram mais severos do que o AP. A maioria dos estudos demonstra ummelhor perfil de segurança do AP quando comparado com o AT, especialmente para células neurorretinianas. No entanto, a dose considerada segura para injeção intravítrea ainda não é bem estabelecida.
3.2.2. Azul de Bromofenol
O Azul de Bromofenol (Brb) tem sido utilizadocomo um indicador ácido-base ou marcador para procedimentos em gel de eletroforese. Em comparação com outros agentes biológicos, o Brbcora bem a MER e MLI sem toxicidade ao EPRin vitro com concentrações de0.2% e 0.02%.55Estudos In vivoem roedores e olhos de porcinos mostraram que essa substância em concentrações de 0.5% e 0.02% promovem menos dano retiniano, evidenciado pela histologia e contagem de células ganglionares, em comparação com três outros corantes (Light-green, Azul Chicago e E68).
O primeiro uso em humano utilizando uma concentração de 0.2% mostrou que cora adequadamente MER com bom perfil de segurança em um período curto de seguimento.56Também ajuda na visualização da hialoide posterior e do vítreo.57
3.2.3. Indocianina Verde
O uso de ICV tem sido proposto para permitir melhor visualização de MER em casos de retinopatia diabéticaproliferativa, MER e identificação de proliferação vítreorretiniana.2,58No entanto, esse corante tem afinidade maior pela MLI acelular.7Apesar de não corar adequadamente a MER, é possível utilizar a ICV e realizar ressecção em bloco das duas membranas, uma vez que a ICV cora adequadamente a MLI e permite a identificação da MER por corar em negativo.59
3.3. Sumário das técnicas de remoção de MER
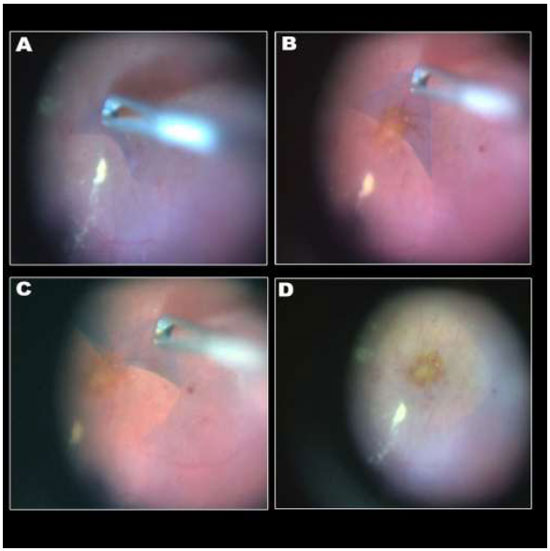
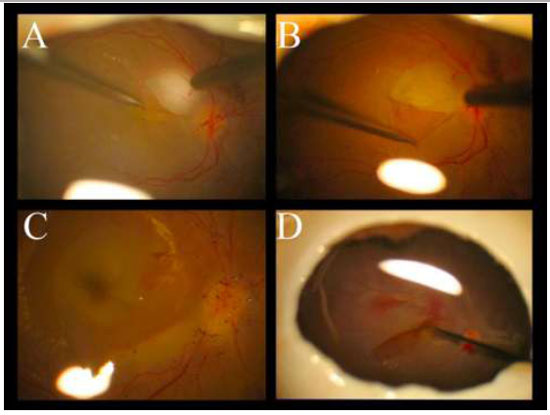
A remoção da MER não é uma manobra tão difícil quanto a MLI e pode ser realizada sem o auxílio de corantes. (Figura 10A)Entretanto, a extensão da MER é melhor avaliadacom o auxíliodacromovitrectomia, seja pela deposição de cristais de TA(Figura 10B)ou utilizando azul tripan - considerado padrão ouro para este procedimento.(Figura 10C)Além disso, é possível utilizar a técnica de “doublestaining”utilizando AT e TA.(Figura 10D)
Atualmente, existe uma tendência à retirada da MLI para evitar a recorrência de MER.60 Esse procedimento pode ser realizado corando a MLI com AB após a retirada da MER. (Figura 11)Outra possibilidade é utilizar apenas o AB. A MLI irá corar apenas na região onde não há MER e esta última será corada em negativo, o que permite a ressecção em bloco da MLI e MER.
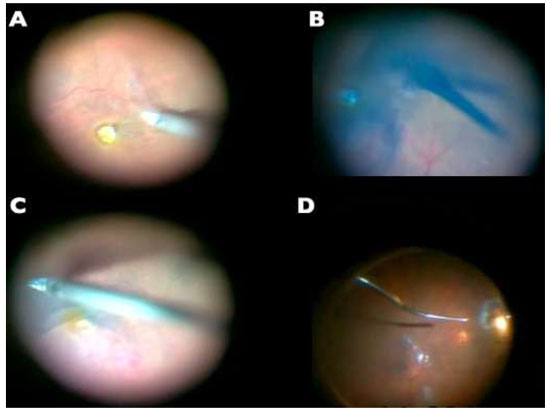
A figura 10 mostra diferentes técnicas para peeling de MER: A-Sem corantes; B-Cristais de triancinolona; C-Azul tripan e D-Cristais de triancinolona + azul tripan.18
4. UTILIZAÇÃO DE CORANTES VITAIS SUB-RETINIANOS PARA IDENTIFICAÇÃO DE ROTURAS RETINIANAS
A localização exata da rotura retiniana é um passo fundamental na cirurgia de descolamento de retina(DR).61Em 2.2% a 4% dos pacientes fácicos com DR a rotura pode não ser evidenciada. Em afácicos e pseudofácicos a incidência de rotura não evidenciável no exame clínico pode variar de 7 a 16% e 5 a 22.5%, respectivamente.62
4.1. Aplicação clínica dos corantes vitais para identificação de roturas retinianas
A primeira aplicação do uso de corantes vitais para identificar roturas foi feita por Black em 1974 ao realizar uma aplicação transescleral de azul de metileno.Esta foi considerada sem sucesso por Hruby e Gass devido à absorção pelo EPR. Mais recentemente, Jackson e colaboradores aplicaram 0.15% de azul tripansub-retiniano utilizando uma cánula 41-gauge para identificação de roturas em um paciente em que não foi visualizada a rotura durante a cirurgia. Apesar do número pequeno de pacientes não permitir avaliação adequada de toxicidade, as roturas retinianas foram identificadas em 4 de 5 pacientes e não houve relato de toxicidade.3,61Apesar de ser uma proposta interessante, essa técnica não é utilizada frequentemente em cromovitrectomia devido aos riscos potenciais ao EPR e por melhor identificação das roturas no intraoperatório, devido ao avanço nos sistemas de visualização.
5. CORANTES VITAIS PARA O VÍTREO
O vítreo tem papel fundamental em diversas patologias vitreorretinianas como buraco macular, edema macular, retinopatia diabética e descolamento de retina. A completa remoção do vítreo pode melhorar o resultado cirúrgico anatômico e funcional.
5.1. Triancinolona Acetonida
Os cristais de TA aderem ao tecido acelular, permitindo um contraste adequado entre a cavidade vítrea vazia e os locais onde ainda há fibras de vítreo. A TA é a substância mais comumente utilizada para identificação do vítreo e a técnica consiste em uma simples aplicação dentro da cavidade vítrea. (Figura12) Após o relato inicial, diversos estudos confirmaram a utilização da TA para este propósito, com raras complicações anatômicas ou funcionais relatadas37Além do efeito na visualização do vítreo, a injeção da TA pode prevenir a formação de proliferação vitreorretiniana (PVR) no pós-operatório; porém, não há dados conclusivos sobre esse efeito.
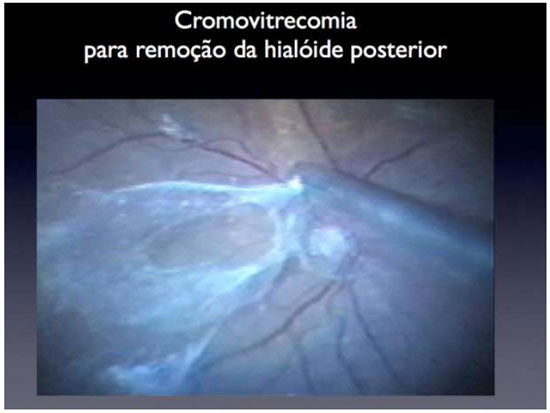
A segurança da TA tem sido demonstrada em vários estudos in vitro e in vivo.7 Injeções intravítreas em altas concentrações (maior que 30 mg) não demonstraram nenhuma toxicidade relevante. Em nossos trabalhos, a TA sem preservativo injetada no espaço sub-retiniano de coelhos não demonstrou toxicidade relevante.63 Foi proposto, recentemente, que o preservativo álcool benzílico presente no veículo da TA seria responsável pela indução de lesões retinianas64,18(Figura 11e Tabela 1)
5.2. Fluoresceína sódica, acetatodeFluormetolona e Azul Tripan
Esses corantes não são utilizados rotineiramente em cromovitrectomia na identificação do vítreo, no entantosão relatados na literatura como possíveis alternativaspara esse procedimento cirúrgico.
5.2.1. Fluoresceína Sódica
A fluoresceína sódica (SF) é bem absorvida pelo vítreo e a utilização de SF 0.6% para facilitar a visualização do vítreo não evidenciou complicações.65A Comparação de 4 substâncias para visualização do vítreo mostrou que a SF é inferior a TA.66Atualmente, seu principal uso em cromovitrectomia é corar o vítreo e estudos futuros podem determinar algum papel na visualização de membranas durante cirurgia de vitrectomia.
5.2.2. Acetato de Fluormetolona
O acetato de fluormetolona (FMA) pode ser preparado como uma suspensão oftálmica. Este esteróide branco pode ser usado para o tratamento de inflamações conjuntivais, corneais e de segmento anterior do olho em geral. Outros autores investigaram a segurança intravítrea e sub-retiniana do FMA em primatas e ratos para possível uso em vitrectomia e não foram observadasalterações histológicas ou eletrorretinográficas que sugerissem toxicidade retiniana, concluindo que o FMA seria uma alternativa útil na cromovitrectomia.
5.2.3. Azul Tripan
O AT, em diferentes doses, pode facilitar a identificação do vítreo. Não houve toxicidade ou dano retiniano quando utilizado a 0.15%para corar o vítreo.7O AT permite a visualização das margens das fibras vítreas.68No entanto, em análise comparativa, o AT corou o vítreo pior do que a TA e SF.66Por esta razão a utilização do AT para visualização do vítreo não ganhou popularidade.
5.3. Sumário de técnica de identificação da hialoide posterior
A identificação da hialoide posterior e o do vítreo da base nos dias atuais é feita utilizando cristais de triancinolona e essa técnica cirúrgica é especialmente importante em retinopatia diabética em pacientes jovens, buracos maculares, síndrome de tração vítreo macular, trauma ocular e vitrectomia primária para tratamento de descolamento de retina. (Figura 12 e Tabela 1)18
6. TÉCNICAS CIRÚRGICAS PARA INJEÇÃO DO CORANTE DURANTE A CIRURGIA
6.1. Técnica de “doublestaining”
Nesta técnica, o primeiro passo consiste na injeção de um corante com afinidade com o vítreo para permitir a remoção adequada do vítreo (triancinolona acetonida -Tabela1), seguido de uma segunda injeção como: IfCV, AT ou AB para corar e remover membranas pré-retinianas.(Figuras 7D and 10D)7,18Pode ser também chamada de “doublestaining” a injeção de um corante vital para facilitar a visualização da MER e outro da MLI com a finalidade de remoção das duas membranas.45
6.2. Reconstituição, Diluição e Concentração
Alguns cuidados especiais devem ser tomados quanto à seleção do solvente ideal para corantes, especialmente em casos em que o agente é fornecido ao cirurgião na sala de cirurgia como um pó, como a ICV.
ICV contém iodo em sua fórmula e deve ser diluída em água pura para evitar sua precipitação e diluída novamente em BSS para evitar uma solução hiposmolar. IfCV não contém iodo, precipita em água, e glicose a 5% é preferível como solvente. Assim, IfCV é uma alternativa para evitar efeitos deletérios da hiposmolaridade. 18
Deve-se buscar corar os tecidos com a menor concentração necessária para distinguir estruturas transparentes.Uma concentração baixa traz menos risco potencial de efeitos tóxicos para a retina e EPR.(Tabela 1)
6.3. Injeção do Corante
Diferentes técnicas já foram descritas para injetar o corante na cavidade vítrea. Em uma delas é realizada uma troca fluído-ar antes da injeção. Apesar de ter a vantagem de concentrar o corante no polo posterior e evitar o contato com o cristalino, pode expor a superfície da retina a uma maior concentração do corante.2Quando o olho está preenchido por ar, toda a concentração do corante injetado atinge a superfície retiniana.
Na segunda técnica,a injeção do corante é realizada com o olho preeenchido por fluído intravítreo (usualmente solução salina balanceada). A concentração do corante que entra em contato com a superfície retiniana é menor devido à diluição no flúido que preenche a cavidade vítrea.A desvantagem dessa técnica é a possível dispersão do agente que pode corar regiões não desejadas pelo cirurgião. Comparação dos dois métodos em modelo porcino concluiu que a injeção com o olho preenchido por ar leva a uma maior incidência de atrofia do EPR e degeneração de retina externa.69Outra preocupação é em relação ao período de incubação do corante na superfície retiniana. Uma vez que retirar o corante mais precocemente minimiza a exposição ao tecido retiniano, existe uma tendência a lavar o corante poucos segundos após sua injeção.70,71
6.4. Proteção ao buraco macular
Foram descritas algumas maneiras de tentar evitar a injeção do corante através do buraco macular: injetar lentamente, colocar substâncias na superfície do buraco como perfluorcarbono, soro autólogo ou hialuronato de sódio. Apesar de técnicas interessantes, elas não são utilizadas amplamente pela maioria dos cirurgiões vitreorretinianos.3,18,71,72,73
6.5. Iluminação
Corantes vitais são substâncias químicas que passam livremente através do tecido retiniano e exacerbam a fototoxicidaderetiniana induzida pela exposição à luz. Corantes fotosensibilizadores podem aumentar a fototoxicidade ao aumentar radicais livres, criando um fotoproduto que pode ser danoso a células retinianas. Clinicamente, experimentos consecutivos demonstraram dano histológico e funcional à retina após a exposição àluz e ICV, quando comparado com a exposição à luz sem aplicação de ICV.74,75,76
Para analisar o risco do dano luminoso induzido pelo corante, fatores como a sobreposição entre o espectro da fonte de luz emitida e da absorção do corante vital, devem ser conhecidos.74Haritoglou et al.76propuseram que uma mudança na faixa de absorção da ICG durante a cirurgia vitreorretiniana, induz efeitos fotossensibilizantes na superfície retiniana. Eles demonstraram que o espectro de absorção da ICG sobrepõe parcialmente o espectro de emissão de um tipo de fonte de luz halogênea, e que a absorção da ICG varia, dependendo do solvente e da osmolaridade. Notavelmente, ICG em solução de glicose a 5%, muda a sua faixa de absorção para comprimentos de ondas maiores em comparação a ICG preparada em BSS, portanto, diminuindo o risco da sobreposição dos espectros com a fonte de emissão de luz.74
A sonda de iluminação deve ser mantida longe da retina e desligada sempre que possível para minimizar a decomposição da ICV e dano térmico.18
7. PERSPECTIVAS FUTURAS
Estudos prévios demonstraram que uma solução contendo luteína/zeaxantina 0.3% e AB 0.025% cora eficientemente o vítreo, MLI e hialoide posterior em olhos cadavéricos.75Avaliações histológicas, eletrorretinográficas e clínicas após a injeção intravítrea dessa substância não mostraram sinais de toxicidade.
Sabemos que os radicais livres de oxigênio (ROS), continuamente gerados na retina, danificam estruturas como fotorreceptores e EPR.81 A luteína e zeaxantina, através da doação de um eletron para o ROS inibe a formação de mais radicais livres e lipoperoxidação.80,81,82,83 Acredita-se, portanto, que esse corante possa ter ação antioxidante e fotoprotetora.
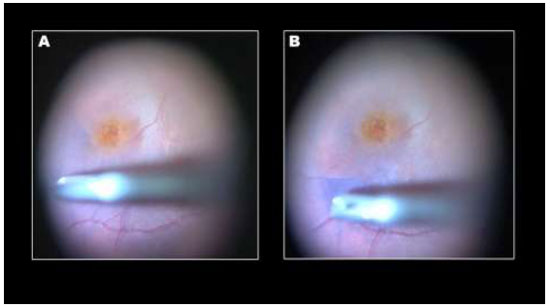
Em estudo prospectivo realizado em 12 olhos acompanhados por 6 meses, foi demonstrado que a combinação de luteína/zeaxantina 0.3% e AB 0.025% resultou em um corante verde.(Figura 13)A acuidade visual inicial melhorou em todos os olhos sem sinais de toxicidade.84A solução final verde era mais densa que BSS e não foi necessária injeção vigorosa no polo posterior.(Figura 14)O depósito de cristais micronizados de luteína/zeaxantina sobre a hialoide posterior e vítreo da base resulta em uma aparência dourada dessas estruturas (Figura 15), enquanto a afinidade do AB pela MLI facilita a remoção dessa membrana em olhos com buraco de mácula (Figura 16),retinopatia diabética proliferativa e edema macular diabético.84Devido ao alto potencial de utilização na prática clínica em humanos, foi realizado um estudo clínico envolvendo 18 pacientes com o objetivo de avaliar o corante à base de luteína/zeaxantina e AB.Dezoito cirurgiões diferentes, com experiência em cromovitrectomia, realizaram cirurgias para tratamento de BM e MER utilizando corante à base de luteína/zeaxantina 0.3% e AB 0.025% e completaram um questionário pós-operatório para avaliar a capacidade do corante para identificar o vítreo e membranas pré-retinianas. Todos cirurgiões consideraram que o novo corante facilita a identificação intraoperatória da MLI, da hialoide posterior e do vítreo da base durante a cirurgia de vitrectomia posterior.85
Novos corantesnaturais estão em estudo em olhos cadavéricos e as antocianinas derivadas do açaí (Euterpeoleracea) demonstraram alta afinidade com a MLI em olhos cadavéricos. (Figura 17)Estudos experimentais e clínicos estão sendo desenvolvidos com o intuito de desenvolver um produto final que possa ser utilizado com segurança em cromovitrectomia em olhos humanos.86
8. CONCLUSÕES E RECOMENDAÇÕES
O advento da cromovitrectomia permitiu melhor visualização de tecidos intraoculares finos e transparentes, facilitando a remoção cirúrgica e consequentemente levando a melhores resultados pós-operatórios.A injeção deve ser delicada, realizada com a infusão desligada, evitando um “flush” vigoroso e deve atingir adequadamente a superfície retiniana. Todas as substâncias que são usadas dentro da cavidade vítrea devem ter uma osmolaridade em torno de 280-300mOsm e pH em torno de 7.00.
Em relação a cada substância especificamente, é recomendado:
A) Triancinolona acetonida é “padrão ouro” para identificação do vítreo da base e da hialoide posterior; deve ser utilizado 0.3 mLemuma concentração de 40mg/mL e semálcool benzílico em sua composição.
B)Azul Tripan é o corante ideal para identificação de MER; deve ser utilizado 0.2-0/3mL do corante em uma concentração de 1.2-1.5mg/ml.A mistura com glicose 5-10% pode ser utilizada (25% de glicose e 75% do corante). O cirurgião deve aguardar 5-10 segundos após injeção para ligar a infusão e continuar o procedimento cirúrgico.
C)Azul Brilhante é o corante ideal para identificação de MLI; deve ser utilizado 0.2-0.3mL do corante em uma concentração de 0.25mg/mL.A mistura com glicose 5-10% pode ser utilizada (25% de glicose e 75% do corante). O cirurgião deve aguardar 5-10 segundos após injeção para ligar a infusão e continuar o procedimento cirúrgico.
D) Outros corantes naturais estão sendo estudados em cromovitrectomia.
REFERÊNCIAS
1. Burk SE, Da Mata AP, Snyder ME, et al. Indocyanine green-assisted peeling of the retinal internal limiting membrane. Ophthalmology 2000;107(11):2010-4.
2. Rodrigues EB, Meyer CH, Kroll P. Chromovitrectomy: a new field in vitreoretinal surgery. Graefes Arch Clin Exp Ophthalmol 2005;243(4):291-3.
3. Rodrigues EB, Costa EF, Penha FM, et al. The use of vital dyes in ocular surgery. Surv Ophthalmol 2009;54(5):576-617.
4. Mester V, Kuhn F. Internal limiting membrane removal in the management of full-thickness macular holes. Am J Ophthalmol 2000;129(6):769-77.
5. Gandorfer A, Haritoglou C, Kampik A, Charteris D. Ultrastructure of the vitreoretinal interface following removal of the internal limiting membrane using indocyanine green. Curr Eye Res 2004;29(4-5):319-20.
6. Wollensak G, Spoerl E, Wirbelauer C, Pham DT. Influence of indocyanine green staining on the biomechanical strength of porcine internal limiting membrane. Ophthalmologica 2004;218(4):278-82.
7. Rodrigues EB, Maia M, et al. Vital dyes for chromovitrectomy. Curr Opin Ophthalmol 2007;18(3):179-87.
8. Maia M, Haller JA, Pieramici DJ, et al. Retinal pigment epithelial abnormalities after internal limiting membrane peeling guided by indocyanine green staining. Retina 2004;24(1):157-60.
9. Maia M, Kellner L, de Juan E, Jr., et al. Effects of indocyanine green injection on the retinal surface and into the subretinal space in rabbits. Retina 2004;24(1):80-91.
10. Maia M, Margalit E, Lakhanpal R, et al. Effects of intravitreal indocyanine green injection in rabbits. Retina 2004;24(1):69-79.
11. Arevalo JF, Garcia RA. Macular hole surgery complicated by accidental massive subretinal indocyanine green, and retinal tear. Graefes Arch Clin Exp Ophthalmol 2007;245(5):751-3.
12. Brazitikos PD, Androudi S, Tsinopoulos I, et al. Functional and anatomic results of macular hole surgery complicated by massive indocyanine green subretinal migration. Acta Ophthalmol Scand 2004;82(5):613-5.
13. Hirata A, Inomata Y, Kawaji T, Tanihara H. Persistent subretinal indocyanine green induces retinal pigment epithelium atrophy. Am J Ophthalmol 2003;136(2):353-5.
14. Rodrigues EB, Meyer CH, Farah ME, Kroll P. Intravitreal staining of the internal limiting membrane using indocyanine green in the treatment of macular holes. Ophthalmologica 2005;219(5):251-62.
15. Brasil OM, Brasil OF. [Comparative analysis of macular hole surgery followed by internal limiting membrane removal with and without indocyanine green staining]. Arq Bras Oftalmol 2006;69(2):157-60.
16. Horio N, Horiguchi M. Effect on visual outcome after macular hole surgery when staining the internal limiting membrane with indocyanine green dye. Arch Ophthalmol 2004;122(7):992-6.
17. Sheidow TG, Blinder KJ, Holekamp N, et al. Outcome results in macular hole surgery: an evaluation of internal limiting membrane peeling with and without indocyanine green. Ophthalmology 2003;110(9):1697-701.
18. Farah ME, Maia M, Rodrigues EB. Dyes in ocular surgery: principles for use in chromovitrectomy. Am J Ophthalmol 2009;148(3):332-40.
19. Lai MM, Williams GA. Anatomical and visual outcomes of idiopathic macular hole surgery with internal limiting membrane removal using low-concentration indocyanine green. Retina 2007;27(4):477-82.
20. Engelbrecht NE, Freeman J, Sternberg P, Jr., et al. Retinal pigment epithelial changes after macular hole surgery with indocyanine green-assisted internal limiting membrane peeling. Am J Ophthalmol 2002;133(1):89-94.
21. Rodrigues EB, Meyer CH. Meta-analysis of chromovitrectomy with indocyanine green in macular hole surgery. Ophthalmologica 2008;222(2):123-9.
22. Kamura Y, Sato Y, Isomae T, Shimada H. Effects of internal limiting membrane peeling in vitrectomy on diabetic cystoid macular edema patients. Jpn J Ophthalmol 2005;49(4):297-300.
23. Bardak Y, Cekic O, Tig SU. Comparison of ICG-assisted ILM peeling and triamcinolone-assisted posterior vitreous removal in diffuse diabetic macular oedema. Eye (Lond) 2006;20(12):1357-9.
24. Radetzky S, Walter P, Fauser S, et al. Visual outcome of patients with macular edema after pars plana vitrectomy and indocyanine green-assisted peeling of the internal limiting membrane. Graefes Arch Clin Exp Ophthalmol 2004;242(4):273-8.
25. Lanzetta P, Polito A, Del Borrello M, et al. Idiopathic macular hole surgery with low-concentration infracyanine green-assisted peeling of the internal limiting membrane. Am J Ophthalmol 2006;142(5):771-6.
26. Rivett K, Kruger L, Radloff S. Infracyanine-assisted internal limiting membrane peeling in macular hole repair: does it make a difference? Graefes Arch Clin Exp Ophthalmol 2004;242(5):393-6.
27. Kolacny D, Parys-Vanginderdeuren R, Van Lommel A, Stalmans P. Vitrectomy with peeling of the inner limiting membrane for treating diabetic macular edema. Bull Soc Belge Ophtalmol 2005(296):15-23.
28. Husson-Danan A, Glacet-Bernard A, Soubrane G, Coscas G. Clinical evaluation of the use of indocyanine green for peeling the internal limiting membrane in macular hole surgery. Graefes Arch Clin Exp Ophthalmol 2006;244(3):291-7.
29. La Heij EC, Dieudonne SC, Mooy CM, et al. Immunohistochemical analysis of the internal limiting membrane peeled with infracyanine green. Am J Ophthalmol 2005;140(6):1123-5.
30. Haritoglou C, Gandorfer A, Gass CA, Kampik A. Histology of the vitreoretinal interface after staining of the internal limiting membrane using glucose 5% diluted indocyanine and infracyanine green. Am J Ophthalmol 2004;137(2):345-8.
31. Kodjikian L, Richter T, Halberstadt M, et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefes Arch Clin Exp Ophthalmol 2005;243(9):917-25.
32. Enaida H, Hisatomi T, Goto Y, et al. Preclinical investigation of internal limiting membrane staining and peeling using intravitreal brilliant blue G. Retina 2006;26(6):623-30.
33. Enaida H, Hisatomi T, Hata Y, et al. Brilliant blue G selectively stains the internal limiting membrane/brilliant blue G-assisted membrane peeling. Retina 2006;26(6):631-6.
34. Cervera E, Diaz-Llopis M, Salom D, et al. [Internal limiting membrane staining using intravitreal brilliant blue G: good help for vitreo-retinal surgeon in training]. Arch Soc Esp Oftalmol 2007;82(2):71-2.
35. Shimada H, Nakashizuka H, Hattori T, et al. Double staining with brilliant blue G and double peeling for epiretinal membranes. Ophthalmology 2009;116(7):1370- 6.
36. Horio N, Horiguchi M, Yamamoto N. Triamcinolone-assisted internal limiting membrane peeling during idiopathic macular hole surgery. Arch Ophthalmol 2005;123(1):96-9.
37. Kampougeris G, Cheema R, McPherson R, Gorman C. Safety of Triamcinolone acetonide (TA)-assisted pars plana vitrectomy in macular hole surgery. Eye (Lond) 2007;21(5):591-4.
38. Shah GK, Rosenblatt BJ, Blinder KJ, et al. Triamcinolone-assisted internal limiting membrane peeling. Retina 2005;25(8):972-5.
39. Karacorlu M, Ozdemir H, Arf Karacorlu S. Does intravitreal triamcinolone acetonide-assisted peeling of the internal limiting membrane effect the outcome of macular hole surgery? Graefes Arch Clin Exp Ophthalmol 2005;243(8):754-7.
40. Maia M, Penha FM, Farah ME, et al. Subretinal injection of preservative-free triamcinolone acetonide and supernatant vehicle in rabbits: an electron microscopy study. Graefes Arch Clin Exp Ophthalmol 2008;246(3):379-88.
41. Lee KL, Dean S, Guest S. A comparison of outcomes after indocyanine green and trypan blue assisted internal limiting membrane peeling during macular hole surgery. Br J Ophthalmol 2005;89(4):420-4.
42. Beutel J, Dahmen G, Ziegler A, Hoerauf H. Internal limiting membrane peeling with indocyanine green or trypan blue in macular hole surgery: a randomized trial. Arch Ophthalmol 2007;125(3):326-32.
43. Haritoglou C, Eibl K, Schaumberger M, et al. Functional outcome after trypan blue-assisted vitrectomy for macular pucker: a prospective, randomized, comparative trial. Am J Ophthalmol 2004;138(1):1-5.
44. Narayanan R, Kenney MC, Kamjoo S, et al. Trypan blue: effect on retinal pigment epithelial and neurosensory retinal cells. Invest Ophthalmol Vis Sci 2005;46(1):304-9.
45. Stalmans P, Feron EJ, Parys-Van Ginderdeuren R, et al. Double vital staining using trypan blue and infracyanine green in macular pucker surgery. Br J Ophthalmol 2003;87(6):713-6.
46. Kwok AK, Lai TY, Li WW, et al. Trypan blue- and indocyanine green-assisted epiretinal membrane surgery: clinical and histopathological studies. Eye (Lond) 2004;18(9):882-8.
47. Uno F, Malerbi F, Maia M, et al. Subretinal trypan blue migration during epiretinal membrane peeling. Retina 2006;26(2):237-9.
48. Balayre S, Boissonnot M, Fernandez B, et al. [Ultrastructural study of epiretinal membrane stained by trypan blue: 15 case reports]. J Fr Ophtalmol 2005;28(2):159-67.
49. Balayre S, Boissonnot M, Paquereau J, Dighiero P. [Evaluation of trypan blue toxicity in idiopathic epiretinal membrane surgery with macular function test using multifocal electroretinography: seven prospective case studies]. J Fr Ophtalmol 2005;28(2):169-76.
50. Lesnik Oberstein SY, Mura M, Tan SH, de Smet MD. Heavy trypan blue staining of epiretinal membranes: an alternative to infracyanine green. Br J Ophthalmol 2007;91(7):955-7.
51. Marmor MF. Retinal detachment from hyperosmotic intravitreal injection. Invest Ophthalmol Vis Sci 1979;18(12):1237-44.
52. Negi A, Marmor MF. Effects of subretinal and systemic osmolality on the rate of subretinal fluid resorption. Invest Ophthalmol Vis Sci 1984;25(5):616-20.
53. Mennel S, Meyer CH, Tietjen A, et al. Patent blue: a novel vital dye in vitreoretinal surgery. Ophthalmologica 2006;220(3):190-3.
54. Luke C, Luke M, Sickel W, Schneider T. Effects of patent blue on human retinal function. Graefes Arch Clin Exp Ophthalmol 2006;244(9):1188-90.
55. Haritoglou C, Yu A, Freyer W, et al. An evaluation of novel vital dyes for intraocular surgery. Invest Ophthalmol Vis Sci 2005;46(9):3315-22.
56. Haritoglou C, Schumann RG, Strauss R, et al. Vitreoretinal surgery using bromphenol blue as a vital stain: evaluation of staining characteristics in humans. Br J Ophthalmol 2007;91(9):1125-8.
57. Haritoglou C, Strauss R, Priglinger SG, et al. Delineation of the vitreous and posterior hyaloid using bromophenol blue. Retina 2008;28(2):333-9.
58. Hillenkamp J, Saikia P, Herrmann WA, et al. Surgical removal of idiopathic epiretinal membrane with or without the assistance of indocyanine green: a randomised controlled clinical trial. Graefes Arch Clin Exp Ophthalmol 2007;245(7):973-9.
59. Foster RE, Petersen MR, Da Mata AP, et al. Negative indocyanine green staining of epiretinal membranes. Retina 2002;22(1):106-8.
60. Sakamoto H, Yamanaka I, Kubota T, Ishibashi T. Indocyanine green-assisted peeling of the epiretinal membrane in proliferative vitreoretinopathy. Graefes Arch Clin Exp Ophthalmol 2003;241(3):204-7.
61. Jackson TL, Kwan AS, Laidlaw AH, Aylward W. Identification of retinal breaks using subretinal trypan blue injection. Ophthalmology 2007;114(3):587-90.
62. Salicone A, Smiddy WE, Venkatraman A, Feuer W. Management of retinal detachment when no break is found. Ophthalmology 2006;113(3):398-403.
63. Ruiz-Moreno JM, Montero JA, Bayon A, et al. Retinal toxicity of intravitreal triamcinolone acetonide at high doses in the rabbit. Exp Eye Res 2007;84(2):342-8.
64. Morrison VL, Koh HJ, Cheng L, et al. Intravitreal toxicity of the kenalog vehicle (benzyl alcohol) in rabbits. Retina 2006;26(3):339-44.
65. Das T, Vedantham V. Intravitreal sodium fluorescein enhances visualization of clear vitreous during vitreous surgery for macular hole: a safety and efficacy study. Clin Experiment Ophthalmol 2004;32(1):55-7.
66. Guo S, Tutela AC, Wagner R, Caputo AR. A comparison of the effectiveness of four biostains in enhancing visualization of the vitreous. J Pediatr Ophthalmol Strabismus 2006;43(5):281-4.
67. Hata Y, Enaida H, Sassa Y, et al. Preclinical investigation of fluorometholone acetate as a potential new adjuvant during vitreous surgery. Graefes Arch Clin Exp Ophthalmol 2007;245(7):1019-25.
68. Verma L, Prakash G, Tewari HK. Trypan blue enhanced vitrectomy in clear gel vitrectomy. Indian J Ophthalmol 2003;51(1):106.
69. Czajka MP, McCuen BW, 2nd, Cummings TJ, et al. Effects of indocyanine green on the retina and retinal pigment epithelium in a porcine model of retinal hole. Retina 2004;24(2):275-82.
70. Schmidt JC, Rodrigues EB, Meyer CH, et al. A modified technique to stain the internal limiting membrane with indocyanine green. Ophthalmologica 2004;218(3):176-9.
71. Meyer CH, Rodrigues EB. A novel applicator for the selective painting of pre-retinal structures during vitreoretinal surgery. Graefes Arch Clin Exp Ophthalmol 2005;243(5):487-9.
72. Rizzo S, Belting C, Genovesi-Ebert F, et al. Modified technique for safer indocyanine-green-assisted peeling of the internal limiting membrane during vitrectomy for macular hole repair. Graefes Arch Clin Exp Ophthalmol 2006;244(12):1615-9.
73. Cacciatori M, Azzolini M, Sborgia M, et al. Sodium hyaluronate 2.3% prevents contact between indocyanine green and retinal pigment epithelium during vitrectomy for highly myopic macular hole retinal detachment. Retina 2004;24(1):160-1.
74. Costa Ede P, Rodrigues EB, Farah ME, et al. Vital dyes and light sources for chromovitrectomy: comparative assessment of osmolarity, pH, and spectrophotometry. Invest Ophthalmol Vis Sci 2009;50(1):385-91.
75. Rodrigues EB, Meyer CH, Mennel S, Farah ME. Mechanisms of intravitreal toxicity of indocyanine green dye: implications for chromovitrectomy. Retina 2007;27(7):958-70.
76. Haritoglou C, Priglinger S, Gandorfer A, et al. Histology of the vitreoretinal interface after indocyanine green staining of the ILM, with illumination using a halogen and xenon light source. Invest Ophthalmol Vis Sci 2005;46(4):1468-72.
77. Malerbi FK, Maia M et al. Subretinal brilliant blue G migration during internal limiting membrane peeling.Br J Ophthalmol. 2009 Dec;93(12):1687.
78. Carpentier C, ZanolliM, Wu L et al. Residual internal limiting membrane after epiretinal membrane peeling. Retina 2013 in press
79. Sousa-Martins D, Maia M, Moraes M, et al. Use of lutein and zeaxanthin alone or combined with brilliant blue to identify intraocular structures intraoperatively. Retina 2012;32:1328-1336.
80. Junghans A, Sies H, Stahl W. Macular pigments lutein and zeaxanthin as blue light filters studied in liposomes. Arch Biochem Biophys. 2001 Jul15;391(2):160-4.
81. Trevithick-Sutton CC, Foote CS, Collins M, et al. The retinal carotenoids zeaxanthin and lutein scavenge superoxide and hydroxyl radicals: a chemiluminescence and ESR study. Mol Vis. 2006 Sep 30;12:1127-35.
82. Stahl W. Macular carotenoids: lutein and zeaxanthin. Dev Ophthalmol. 2005;38:70-88.
83. Kijlstra A, Tian Y et al. Lutein: more than just a filter for blue light. Prog Retin Eye Res.2012 Jul;31(4):303-15.
84. Maia M, Furlani BA, Souza-Lima AA, Martins DS, Navarro RM, Belfort R Jr. Lutein: a new dye for chromovitrectomy. Retina. 2014 Feb;34(2):262-72.
85. Badaro E, Furlani B, Prazeres J, Maia M, Lima AA, Souza-Martins D, Muccioli C, Lucatto LF, Belfort R Jr. Soluble lutein in combination with brilliant blue as a new dye for chromovitrectomy. Graefes Arch Clin Exp Ophthalmol. 2014 Jul;252(7):1071-8.
86. Chen J, Ferreira MA, Farah ME, et al. Posterior hyaloid detachment and internal limiting membrane peeling assisted by anthocyanins from acai fruit (Euterpe oleracea) and 10 other natural vital dyes: experimental study in cadaveric eyes.Retina. 2013 Jan;33(1):89-96
Fonte de financiamento: declaram não haver.
Conflito de interesses: declaram não haver.
Recebido em:
9 de Novembro de 2015.
Aceito em:
13 de Novembro de 2015.