Kenzo Hokazono; Ana Bárbara Dias Lopes Urzedo
DOI: 10.17545/eOftalmo/2024.0003
Este artigo pertence à Edição Especial Edição especial Neuro
A neuropatia óptica isquêmica anterior (NOIA) é a causa mais comum de neuropatia óptica aguda após os 50 anos, causada pela isquemia das artérias ciliares posteriores curtas. Dentre os fatores de risco, cabe citar a hipertensão arterial sistêmica (HAS), diabetes mellitus (DM) e disco óptico cheio (“crowded”). O diagnóstico é clínico, sendo o quadro bastante característico: diminuição da acuidade visual súbita, indolor, unilateral, geralmente em um paciente idoso e após acordar. Ao exame oftalmológico, nota-se, principalmente, edema de disco e hemorragia peripapilar (Figura 1), além de defeito pupilar aferente relativo (DPAR). A NOIA pode ser classificada como NOIA arterítica (NOIA-A) e não-arterítica (NOIA-NA), com diferenças epidemiológicas, clínicas e terapêuticas importantes. Dessa forma, diante de um quadro de neuropatia óptica, torna-se imprescindível realizar o diagnóstico diferencial entre as diversas etiologias1.
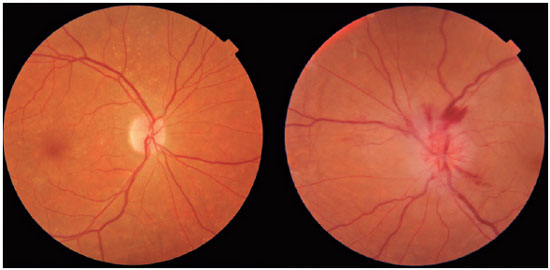
Diante de um quadro de neuropatia óptica, algumas etiologias devem ser consideradas, como: inflamatória, compressiva, tóxica, carencial, hereditária, degenerativa, infecciosa ou vascular1,2.
No diagnóstico diferencial das diversas causas de neuropatias ópticas, o raciocínio clínico torna-se imprescindível. Em casos de neuropatias ópticas que cursam com apresentação súbita, como é o caso da NOIA, as causas compressivas, tóxico-carenciais, hereditárias e degenerativas tornam-se etiologias improváveis, uma vez que cursariam com apresentação crônica e indolente. Por sua vez, as causas inflamatórias, que tem como principal exemplo a neurite óptica, diferentemente da NOIA, apresentam perda visual associada a dor à movimentação ocular de evolução subaguda (dentro de dois a três dias). Além disso, a neurite óptica afeta principalmente mulheres jovens e acomete mais comumente a porção retrobulbar do nervo óptico e, por isso, ao exame, não apresenta de edema de disco. Por outro lado, as doenças infecciosas podem ser diferenciadas por apresentarem algum grau de inflamação ocular, como reação de câmara anterior ou reação vítrea, além de sinais e sintomas sistêmicos, como febre, artralgia ou rash cutâneo1,2.
Sabe-se, ainda, que DM pode cursar com papilopatia diabética, um tipo de neuropatia óptica. No entanto, esse quadro é mais comum em pacientes jovens com DM tipo 1 e a perda visual geralmente é leve3. A HAS pode estar associada a um subtipo de oclusão de veia central da retina denominada papiloflebite, mas que também é mais comum em pacientes jovens e cursa com perda visual leve. Nestes casos, os pacientes apresentam hiperemia e edema de disco moderado, dilatação venosa sobre o disco óptico, presença de escotomas na campimetria visual e ausência de defeito pupilar aferente relativo (DPAR)1.
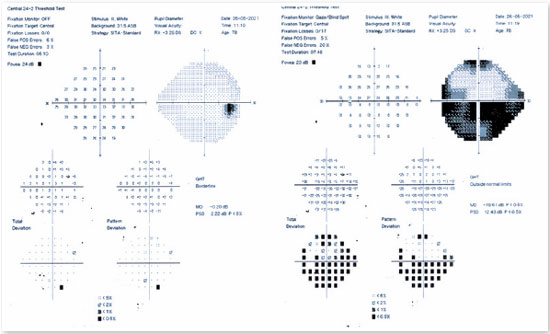
Dentre os exames complementares úteis na confirmação do diagnóstico de NOIA, é importante ressaltar a campimetria visual computadorizada, pois o defeito evidenciado na campimetria é característico desta doença: defeito altitudinal, um defeito que afeta metade do campo visual (Figura 2). É importante recordar que doenças compressivas causariam defeito difuso do campo visual; etiologias tóxicas, nutricionais e hereditárias apresentariam defeitos cecocentrais (escotomas centrais que se unem à mancha cega); e causas infecciosas ou inflamatórias cursariam, principalmente, com defeitos centrais1.
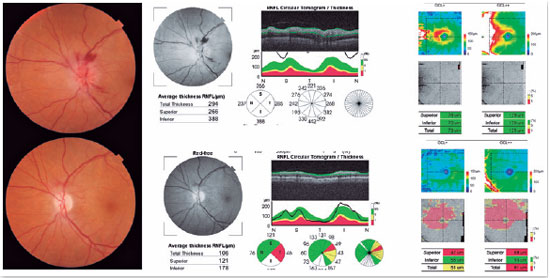
A tomografia de coerência óptica (OCT) também pode auxiliar no diagnóstico, pois além de detectar o edema setorial de disco (Figura 3), pode fornecer dados que excluem outras causas de neuropatia óptica, como edema e exsudatos maculares nos casos de neurorretinite, e hiperrefletividade da camada de fotorreceptores nos casos de neurite por sífilis1.
Entre os exames laboratoriais, hemograma e sorologias são úteis para descartar doenças infecciosas, como sífilis, doença da arranhadura do gato e doença de Lyme. A glicemia de jejum e a hemoglobina glicada são importantes para excluir papilopatia diabética, e a avaliação da HAS pode auxiliar no diagnóstico de papiloflebite. Outros exames, como anticorpo antinuclear (FAN) e prova tuberculínica (PPD) podem auxiliar no diagnóstico de doenças menos comuns, como vasculites e tuberculose1,2.
Exames de imagem, como tomografia computadorizada e ressonância magnética orbitária, podem excluir causas compressivas/tumorais do nervo óptico1.
Uma vez realizado o diagnóstico de NOIA, é fundamental diferenciar entre as suas duas formas: arterítica e não arterítica. A forma arterítica, geralmente associada à arterite de células gigantes, pode causar perda visual irreversível no olho contralateral em 50% dos casos e, portanto, deve ser tratada agressivamente com corticosteroides. Nesses casos, a proteína C reativa (PCR) e a velocidade de hemossedimentação (VHS) são exames laboratoriais indispensáveis, uma vez que a NOIA arterítica cursa com elevação significativa desses marcadores inflamatórios e altos níveis de ambos os marcadores apresenta sensibilidade de 97% na detecção da doença4.
Abaixo estão algumas características que diferenciam as duas condições (Tabela 1).
Em relação ao tratamento, é importante ressaltar que nenhum tratamento mostrou-se efetivo em melhorar a acuidade visual na NOIA-NA. A maior parte dos pacientes permanece estável ao longo do tempo, com estabilização da acuidade visual nos primeiros 2 meses, mas 16-42% dos pacientes podem recuperar 3 linhas de visão. Além disso, episódios recorrentes de perda visual no mesmo olho após 3 meses são incomuns (variando de 3% a 8%) e são mais frequentes em pacientes jovens. A incidência de acometimento do olho contralateral varia de 15-24% em 15 anos5.
REFERÊNCIAS
1. Monteiro MLR, Alves MR. Neuroftalmologia. 3ª edição, Rio de Janeiro: 2013.
2. Kandeger BT, Tok O, Tok L. Clinical, demographic characteristics, and treatment protocols of optic neuropathies: Three-year follow-up experiences from a tertiary hospital in Turkey. Curr J Neurol. 2022;21(3):170–177.
3. Kovacova A, Shotliff K. Eye Problems in People with Diabetes: More than Just Diabetic Retinopathy. Pract Diabetes. 2022;39(1):34-39a.
4. Parikh M, Miller NR, Lee AG, Savino PJ, Vacarezza MN, Cornblath W, et al. Prevalence of a normal C-reactive protein with an elevated erythrocyte sedimentation rate in biopsy-proven giant cell arteritis. Ophthalmology. 2006;113(10):1842-1845.
5. Lee YC, Wang JH, Huang TL, Tsai RK. Increased risk os stroke in patients with nonarteritic anterior ischemic optic neuropathy: a nationwide retrospective cohort study. Am J Ophthalmol. 2016 Oct;170:183-189.
INFORMAÇÃO DOS AUTORES |
|
 |
» Kenzo Hokazono https://orcid.org/0000-0003-2897-6833 http://lattes.cnpq.br/6977006766618836 |
 |
» Ana Bárbara Dias Lopes Urzedo https://orcid.org/0000-0003-1113-3186 http://lattes.cnpq.br/8922699183833094 |
Financiamento: Declaram não haver.
Conflitos de Interesse: Declaram não haver.
Recebido em:
6 de Junho de 2023.
Aceito em:
13 de Setembro de 2023.