Filipe Moreira de Araújo1,2; Paula Paiva Pegoraro1,2; Fernando Paganelli1,2,3
DOI: 10.17545/eOftalmo/2021.0010
RESUMO
Ceratocone raramente é uma emergência, a menos quando há hidropsia corneana, ruptura da membrana de Descemet que permite o vazamento do humor aquoso para o estroma corneano, levando à redução abrupta da visão, podendo ser acompanhada de dor, desconforto e fotofobia. O tratamento desta condição clínica tem sido controverso. Este relato apresenta um caso clínico em que a paciente com diagnóstico de ceratocone em ambos os olhos compareceu ao serviço de emergência com quadro de dor, irritação e fotofobia no olho direito, com início súbito. Orientou-se jejum e repouso e foram prescritos colírios das seguintes soluções: dimetilpolisiloxane quatro vezes ao dia, tropicamida três vezes ao dia e moxifloxacino a cada hora até a intervenção proposta: injeção intraestromal corneana de 100µL de sangue autólogo. No pós-operatório imediato notava-se ausência do sinal de Seidel ou hifema. Durante o seguimento, a paciente manteve-se assintomática com notável reabsorção do sangue autólogo, aguardando transplante penetrante de córnea. O preenchimento das fendas estromais com sangue autólogo mostrou-se eficaz em bloquear o vazamento do aquoso mediante processo de coagulação/inflamação perifistular corneana. Demonstra-se, portanto, um método seguro de “contenção de danos” até a viabilidade do procedimento resolutivo.
Palavras-chave: Ceratocone; Córnea; Ectasia; Complicação; Hidropsia.
ABSTRACT
Keratoconus is rarely an emergency, unless when there is corneal hydrops, a rupture of Descemet’s membrane that allows aqueous outflux into the corneal stroma, resulting in abrupt vision reduction, and can be accompanied by pain, discomfort and photophobia. The treatment of this clinical condition has been controversial. This report presents a clinical case in which the patient with a diagnosis of keratoconus in both eyes attended the emergency service with pain, itching and photophobia in the right eye, with sudden onset. She was instructed to fast and rest and eye drops of the following solutions were prescribed: dimethylpolysiloxane four times a day, tropicamide three times a day and moxifloxacin every hour until the proposed intervention: intraestromal corneal injection of 100µL of autologous blood. In the immediate postoperative period, absence of Seidel or hyphema was noted. During the follow-up, the patient remained asymptomatic with notable autologous blood resorption, awaiting penetrating corneal transplant. Filling stromal clefts with autologous blood proved to be effective in blocking aqueous leakage by a process of corneal perifistular coagulation/inflammation. Therefore, a safe method of “damage containment” until the viability of the resolutive procedure is demonstrated.
Keywords: Cornea; Keratoconus; Ectasia; Complication; Hydrops.
INTRODUÇÃO
O ceratocone anterior é uma ectasia corneana não inflamatória caracterizada por um afinamento do estroma corneano central ou paracentral, acompanhado por protrusão apical (formato de cone) e astigmatismo irregular1. Geralmente é bilateral, assimétrico, com maior progressão na adolescência; entretanto, quando os critérios diagnósticos e de imagem permitem a detecção subclínica, é observado envolvimento unilateral em até 4% dos casos2. A história familiar está presente em apenas 6-8% dos casos, sugerindo transmissão autossômica dominante com penetrância incompleta. A associação com doenças sistêmicas, como doença atópica (que está associada ao ceratocone anterior em até 53% dos casos), síndrome de Down ou algumas condições não inflamatórias do tecido conjuntivo, como Ehlers-Danlos e osteogênese imperfeita3, já está bem descrita na literatura4. A relação dessas doenças com o ceratocone provavelmente deve-se ao microtrauma causado pelo ato de esfregar os olhos1. O diagnóstico é feito por biomicroscopia, ceratometria, ceratoscopia, topografia corneana e tomografia de coerência óptica (OCT) do segmento ocular anterior 4.
O tratamento do ceratocone depende do estado do caso e varia desde medidas comportamentais gerais de precaução, passando pelo controle da progressão (crosslinking corneano) e a reabilitação visual (correção com óculos, adaptação de lentes de contato rígidas, anel intraestromal), até os transplantes de córnea, lamelares ou não1. O ceratocone raramente é uma emergência, a menos que haja hidropisia da córnea, um evento raro em casos de ceratocone (3%)5, definido por uma ruptura da membrana de Descemet, permitindo um fluxo súbito de humor aquoso para o estroma corneano e levando à perda repentina da visão, que pode ser acompanhada de dor, desconforto e fotofobia6. O tratamento proposto em episódios agudos de hidropisia é a administração tópica de colírios cicloplégicos, hipotensores, de solução salina hipertônica, além do uso de curativos compressivos e lentes de contato terapêuticas1.
Foi descrita na literatura a resolução acelerada da fase aguda com uma injeção intracameral de gás, que funciona como uma barreira mecânica, reduzindo o fluxo do humor aquoso para o estroma. São preferidos gases que permanecem por mais tempo na câmara anterior, tais como o hexafluoreto de enxofre (SF6) a 20%, que permanece por mais de duas semanas, e o perfluoropropano (C3F8) a 14%, que permanece por mais de seis semanas7. A ruptura cicatriza-se espontaneamente em seis a doze semanas, mas geralmente com piora significativa da visão, devido à opacidade do estroma, sendo necessária uma ceratoplastia penetrante se não houver melhora do edema em três meses ou se houver uma cicatriz no estroma comprometendo o eixo visual1.
O quadro de hidropisia corneana com perfuração espontânea é muito raro8,9 e passa a ser a prioridade do tratamento. O preenchimento com sangue autólogo das fendas estromais inerentes à fisiopatologia da hidropisia10 provou ser eficaz no bloqueio do extravasamento aquoso promovido pela coagulação e inflamação perifistular da córnea. O objetivo deste relato é demonstrar um método eficaz de manejo da hidropisia nessa condição.
RELATO DE CASO
Paciente M. A. Q., mulher de 24 anos, branca, sem comorbidades sistêmicas, procurou o serviço de pronto atendimento com quadro de dor significativa, prurido e fotofobia no olho direito (OD) desde o dia anterior, de início súbito. Fazia acompanhamento oftalmológico devido a um diagnóstico de ceratocone em ambos os olhos.
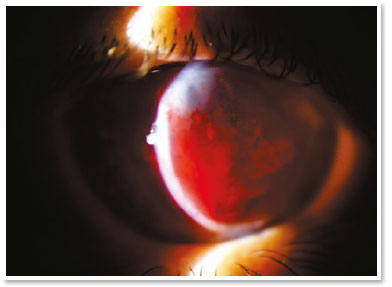
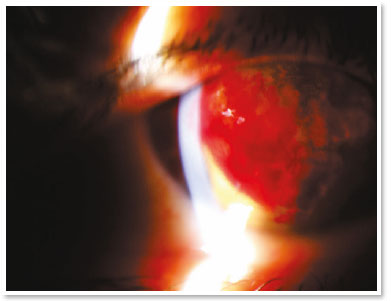
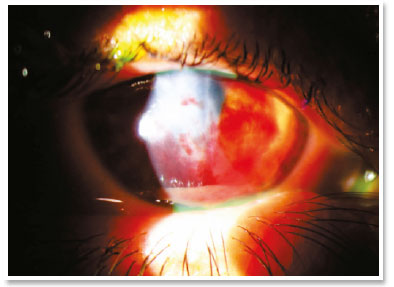
Apresentava acuidade visual (AV) de movimento de mão no OD e de 0,4 no olho esquerdo (OE). A biomicroscopia do OD mostrou hidropisia corneana central de aproximadamente 8 × 7mm, com sinal de Seidel ativo no quadrante temporal superior; no OE, apenas um anel de Fleischer foi digno de nota. Alternativas como lentes de contato ou revestimento com membrana amniótica não eram viáveis para tratar a perfuração na ocasião (a adaptação de uma lente seria impossível, devido à pronunciada protuberância da hidropisia). A paciente foi orientada a seguir em jejum e repouso, e foram prescritos colírios das seguintes soluções: dimetilpolissiloxano quatro vezes ao dia, tropicamida três vezes ao dia e moxifloxacino de hora em hora até o momento da intervenção proposta.
No centro cirúrgico, sob anestesia tópica (cloridrato de tetracaína 1%/cloridrato de fenilefrina 0,1%) e condições estéreis pós uso tópico de idopovidona 10% periocular direito e colocação de campos, aspirou-se 3ml de sangue venoso periférico em membros superior direito via punção prévia. Aproximadamente 100 microlitros deste sangue autólogo foram injetados no estroma corneano com seringa de insulina e uma agulha de 30 gauges (manualmente angulada em aproximadamente 45 graus de modo a facilitar tecnicamente a injeção contínua sob microscópio cirúrgico). O bisel da agulha foi direcionado ao estroma corneano próximo ao cisto estromal preenchido por humor aquoso de modo a se observar o sangue tomando o espaço do humor aquoso intracístico. A avaliação do segmento anterior alguns instantes pós injeção certificou ainda a ausência de sangue migrado para a câmara anterior.
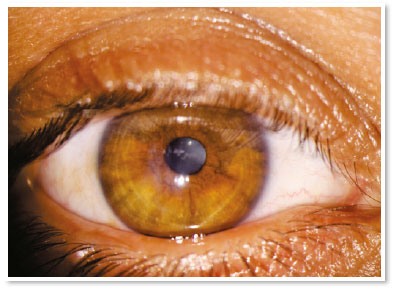
No pós-operatório imediato, não houve extravasamento aquoso ou hifema e o colírio de moxifloxacino foi mantido até o primeiro dia do pós-operatório. Durante todo o acompanhamento até o sexto mês do pós-operatório, a paciente permaneceu assintomática e com notável reabsorção do sangue autólogo, aguardando um transplante penetrante de córnea no OD.
DISCUSSÃO
Quadros de hidropisia corneana merecem atenção especial em termos de manejo, considerando a piora repentina da acuidade visual, o desconforto e a fotofobia importante. A compreensão de sua fisiopatologia já é uma realidade fundamental capaz de orientar uma abordagem terapêutica. A ruptura da membrana de Descemet, ao permitir que o humor aquoso infiltre o estroma, faz com que a membrana se retraia depois de romper-se sob pressão, de modo que um perfeito realinhamento das duas partes não é mais possível, seja espontaneamente ou com algum tipo de tratamento11. A regressão da hidropisia, portanto, ocorre em duas etapas: primeiro ocorre a reconexão da membrana de Descemet ao estroma posterior e posteriormente a migração das células endoteliais para o espaço entre as partes da membrana. O tempo de resolução e o prognóstico estão relacionados ao tamanho da ruptura6.
O tratamento com gás intracameral (C3F8 ou SF6) visa acelerar a primeira etapa, mas há muita discussão sobre a validade dessa injeção diante de alguns fatos, como a necessidade de reaplicações e de decúbito dorsal prolongado. Sabe-se que a hidropisia corneana é autolimitada em aproximadamente quatro meses e estudos mostram que não há diferença significativa no uso desses gases no que diz respeito à acuidade visual final ou à densidade das células endoteliais12. Deve-se ter em mente a possibilidade de eventos incomuns, mas graves, tais como bloqueio pupilar ou síndrome de Urrets–Zavalia13. Por outro lado, acelerar a fixação da membrana de Descemet parece reduzir o estímulo para desenvolver neovascularização corneana (algo crucial em termos de prognóstico para um futuro transplante)11. No presente caso de hidropisia com sinal de Seidel positivo, o uso de gás não parecia ser uma boa opção, devido à possibilidade de uma migração intraestromal do gás e também à necessidade de a paciente manter-se na posição supina por um longo período (duas semanas) tendo necessidade de trabalhar.
Alió et al.14 descreveram o manejo bem-sucedido de um caso de hidropisia corneana com uma injeção guiada por OCT de plasma autólogo hemoderivado rico em plaquetas em uma paciente com síndrome de Down. Naquele caso, porém, foi realizada uma injeção intracameral. A ideia do uso do hemoderivado é justificada pelo seu alto nível de fatores de crescimento, citocinas e moléculas de adesão celular essenciais no processo de cicatrização. Recentemente, têm sido produzidos muitos estudos sobre o uso do chamado “plasma ocular rico em plaquetas” na síndrome do olho seco, na reconstrução da superfície ocular e em úlceras persistentes da córnea. Esse material é obtido usando-se nitrato de sódio a 3,2% como anticoagulante e centrifugação para separar o plasma, que é rico em plaquetas15.
As particularidades do presente caso de hidropisia com sinal de Seidel positivo fazem com que o objetivo do tratamento não se restrinja apenas a restaurar a arquitetura do estroma, mas inclua também uma forma de selar a passagem intraestromal pela qual o humor aquoso alcansava o meio externo. Após a coagulação intraestromal, o sangue autólogo injetado no estroma foi capaz de interromper o vazamento, além de trazer consigo os benefícios do hemoderivado. Por ser intraestromal, a injeção reduz a possibilidade de elevação da pressão intraocular, mesmo que transitória, como foi observado no caso descrito por Alió et al.14
O uso da membrana amniótica na reconstrução da superfície ocular já está bem estabelecido. A membrana atua facilitando a migração epitelial, reforçando a adesão das células basais, promovendo a diferenciação epitelial e prevenindo a apoptose16. Portanto, na hidropisia com sinal de Seidel positivo, essa técnica funcionaria de forma mais superficial, de modo que o caminho seguido pelo humor aquoso dentro do estroma continuaria existindo. Em um estudo de dez casos, Azuara-Blanco et al.17 também demonstraram a ineficiência do uso da membrana amniótica como remendo em perfurações iminentes ou recentes.
Da mesma forma, o cianoacrilato não parecia ser uma boa alternativa no presente caso, pois não é biodegradável e induz resposta inflamatória, neovascularização corneana, sensação de corpo estranho e necrose tecidual18. Mesmo a cola de fibrina, que sendo um composto biológico e biocompatível19 não tem tais desvantagens do cianoacrilato, não fora aventada para o caso já que seu mecanismo de ação para tamponar o vazamento de humor aquoso atuaria apenas superficialmente na superfície externa da córnea, a despeito do sangue autólogo intraestromal proposto que seria capaz de bloquear todo o percurso que o humor aquoso faria através da córnea ao meio externo. O uso de uma lente de contato terapêutica era inviável para aquela anatomia corneana específica.
Lesões localizadas no eixo visual são preditivas de formação de cicatriz, com notável influência no prognóstico visual e necessidade de transplante de córnea para tratamento óptico. No entanto, a opção de um transplante penetrante não foi considerada, uma vez que já foram determinadas altas taxas de rejeição em quadros agudos20.
O uso do sangue autólogo intraestromal tem se mostrado uma alternativa eficaz: sua coagulação nas fendas inerentes à patogênese da hidropisia evita tanto a saturação estromal pelo humor aquoso quanto seu extravasamento, trazendo ainda os benefícios de um hemoderivado15, ao passo que a infusão intracameral já descrita como bem-sucedida por Alió et al.14 não foi sugerida neste caso devido a aspectos como picos de pressão causados pela deposição de proteínas plasmáticas humanas na malha trabecular, levando a uma dificuldade de drenagem do humor aquoso e simulando, por exemplo, uma uveíte prévia21.
O preenchimento com sangue autólogo das fendas estromais inerentes à fisiopatologia da hidropisia provou ser eficaz no bloqueio do extravasamento aquoso promovido pelo processo de coagulação e inflamação perifistular da córnea. Assim, demonstra ser um método seguro de “contenção de danos” para garantir a viabilidade do procedimento resolutivo (transplante penetrante).
REFERÊNCIAS
1. Mannis MJ, Holland EJ. Cornea: Fundamentals, diagnosis and management. Amsterdam: Elsevier; 2017.
2. Rabinowitz YS, Nesburn AB, McDonnell PJ. Videokeratography of the fellow eye in unilateral keratoconus. Ophthalmology. 1993;100(2):181-186. doi: 10.1016/S0161-6420(93)31673-8
3. Rabinowitz YS. Keratoconus. Surv Ophthalmol. 1998;42(4):297-319. doi: 10.1016/S0039-6257(97)00119-7
4. Wagner H, Barr JT, Zadnik K. Collaborative longitudinal evaluation of keratoconus (CLEK) study: Methods and findings to date. Cont Lens Anterior Eye. 2007;30(4):223-232. doi: 10.1016/j.clae. 2007.03.001
5. Mohebbi M, Pilafkan H, Nabavi A, Mirghorbani M, Naderan M. Treatment of acute corneal hydrops with combined intracameral gas and approximation sutures in patients with corneal ectasia. Cornea. 2020;39(2):258-262. doi: 10.1097/ICO.0000000000002155
6. Basu S, Vaddavalli PK, Vemuganti GK, Hasnat A, Murthy SI. Anterior segment optical coherence tomography features of acute corneal hydrops. Cornea. 2012;31(5):479-485. doi: 10.1097/ICO.0b013e318223988e
7. Panda A, Aggarwal A, Madhavi P, et al. Management of acute corneal hydrops secondary to keratoconus with intracameral injection of sulfur hexafluoride (SF6). Cornea. 2007;26(9):1067-1069. doi: 10.1097/ICO.0b013e31805444ba
8. Rubsamen PE, McLeish WM. Keratoconus with acute hydrops and perforation. Brief case report. Cornea. 1991;10(1):83-84. doi: 10.1097/00003226-199101000-00019
9. Nicoli C, Wainsztein RD, Trotta LP. Corneal topography of spontaneous perforation of acute hydrops in keratoconus. J Cataract Refract Surg. 1999;25(6):871-872. doi: 10.1016/S0886-3350(99)00028-0
10. Greenwald MF, Vislisel JM, Goins KM. Acute corneal hydrops [Internet]. EyeRounds.org; 2016. [cited 2020 5 20]. Available at: http://eyerounds.org/cases/241-acute-corneal-hydrops.htm
11. Fan Gaskin JC, Patel DV, McGhee CNJ. Acute corneal hydrops in keratoconus-new perspectives. Am J Ophthalmol. 2014;157(5): 921-928. doi: 10.1016/j.ajo.2014.01.017
12. Basu S, Vaddavalli PK, Ramappa M, Shah S, Murthy SI, Sangwan VS. Intracameral perfluoropropane gas in the treatment of acute corneal hydrops. Ophthalmology. 2011;118(5):934-939. doi: 10.1016/j.ophtha.2010.09.030
13. Vanathi M, Mohan S, Dada T, Panda A. Malignant glaucoma after intracameral isoexpansile perfluoropropane tamponade for the management of acute corneal hydrops. Cornea. 2010;29(7):838 doi: 10.1097/ICO.0b013e3181c6b4e1
14. Alió JL, Toprak I, Rodriguez AE. Treatment of severe keratoconus hydrops with intracameral platelet-rich plasma injection. Cornea. 2019;38(12):1595-1598. doi: 10.1097/ICO.0000000000002070
15. Alió JL, Rodriguez AE, WróbelDudzińska D. Eye platelet-rich plasma in the treatment of ocular surface disorders. Curr Opin Ophthalmol. 2015;26(4):325-332. doi: 10.1097/ICU.0000000000000169
16. Yildiz EH, Nurozler AB, Aksoy NO, Altiparmak UE, Onat M, Karaguzel H, et al. Amniotic membrane transplantation: indications and results. Eur J Ophthalmol. 2008;18(5):685-690. doi: 10.1177/ 112067210801800504
17. Azuara-Blanco A, Pillai CT, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Br J Ophthalmol. 1999;83(4):399-402. doi: 10.1136/bjo.83.4.399
18. Sharma A, Kaur R, Kumar S, Gupta P, Pandav, S, Patnaik B, et al. Fibrin glue versus N-butyl-2-cyanoacrylate in corneal perforations. Ophthalmology. 2003;110(2):291-298. doi: 10.1016/S0161-6420(02)01558-0
19. Radosevich M, Goubran HI, Burnouf T. Fibrin sealant: scientific rationale, production methods, properties, and current clinical use. Vox Sang. 1997;72(3):133-43. doi: 10.1046/j.1423-0410.1997.7230133.x. PMID: 9145483.
20. Bhatt P, Lim LT, Ramaesh K. Therapeutic deep lamellar keratoplasty for corneal perforations. Eye. 2007;21(9):1168-1173. doi: 10.1038/sj.eye.6702428
21. Epstein DL, Hashimoto JM, Grant WM. Serum obstruction of aqueous outflow in enucleated eyes. Am J Ophthalmol. 1978; 86(1):101-105. doi: 10.1016/0002-9394(78)90023-5
INFORMAÇÃO DOS AUTORES

Financiamento: Declaram não haver
Conflitos de Interesse: Declaram não haver
Recebido em:
13 de Outubro de 2020.
Aceito em:
2 de Novembro de 2020.