Marcos Ávila1; José Maurício Botto de B. Garcia2; David Leonardo Cruvinel Isaac3
DOI: 10.17545/e-oftalmo.cbo/2015.18
RESUMO
OBJETIVO: O objetivo deste estudo é discutir o manejo atual da degeneração macular relacionada à idade (DMRI), seca e úmida. Novas opções diagnosticas e terapêuticas, baseadas em resultados de estudos importantes, com diferentes abordagens como os protocolos “PRN” e “tratar e estender” e em tendências futuras, têm remodelado o paradigma do tratamento da DMRI.
MÉTODOS: Este estudo descritivo apresenta uma análise abrangente, focada em informações atuais do “estado da arte”, além de esclarecer algumas trajetórias futuras plausíveis de abordagem da DMRI.
RESULTADOS: O conhecimento atual sobre distintos mediadores “angiogênicos” e inflamatorios, incluindo VEGFs, FCDP e PIGF entre outros, modificou a compreensão sobre a patogênese da DMRI. Esses dados alteraram as opções de tratamento objetivando otimizar os resultados. Considerando o caráter crônico da DMRI, a maioria dessas opções, ainda em modelos experimentais, pode representar alternativas futuras. As drogas antiangiogênicas ainda constituem a linha principal de tratamento, porém ensaios recentes, tais como a terapia combinada têm demonstrado resultados promissores. Os avanços da TCO merecem atenção especial, por se tratar de uma ferramenta importante para condutas rotineiras.
CONCLUSÃO: Apesar de avanços notáveis no tratamento da DMRI seca e úmida, os pacientes ainda necessitam frequentemente de injeções e consultas clínicas. As tendências futuras podem potencialmente mudar esse paradigma. A DMRI é um distúrbio crônico e, independentemente da estratégia de tratamento utilizada, existe um consenso de que os melhores desfechos são alcançados com detecção e tratamento precoces.
Palavras-chave: DRMI. Degeneração Macular. Inibidores da Angiogénese. Neovascularização Patológica. Tomografia de coerência óptica.
ABSTRACT
OBJECTIVE: The present study aimed to discuss the current management for dry and wet age-related macular degeneration (AMD). Emerging diagnostic and therapeutic options supported by the results of pivotal studies, different approaches such as “pro re nata (PRN)” and “treat-and-extend” protocols, and future trends have reshaped the AMD-treatment paradigm.
METHODS: This descriptive report provides a comprehensive analysis, focusing on the present “state of the art” literature, and also highlights some plausible pathways for future AMD treatment strategies.
RESULTS: The current understanding of the different angiogenesis and inflammatory mediators, including vascular endothelial growth factor, platelet-derived growth factor, and placental growth factor, has changed our understanding about AMD pathogenesis. This data has altered treatment options, aiming optimal results. Most of these pathways are still in the experimental stage, and may represent future alternatives, considering the chronic description of AMD. The antiangiogenic drugs remain the mainstay of AMD treatment, but recent trials, such as combination therapy, have revealed promising results. Optical coherence tomography advances also deserve special attention, since it is an important tool that is used on a regular basis for management of this condition.
CONCLUSION: In spite of the significant advances in dry and wet AMD treatments, patients still require frequent injections and clinical appointments. Future trends have the potential to change this paradigm. AMD is a chronic disorder, and the consensus is that the best results will be accomplished with prompt detection and treatment, independent of the treatment strategy selected.
Keywords: Macular Degeneretion. Angiogenesis Inhibitors. Neovascularization. Pathologic. Tomography. Optical Coherence.
INTRODUÇÃO
A degeneração macular relacionada à idade (DMRI) é uma das causas mais comuns de perda da visão no mundo desenvolvido. Ela é responsável por mais de 50% de todos os pacientes considerados oficialmente cegos nos Estados Unidos e espera-se que sua incidência seja o dobro em 2020. A DMRI é convencionalmente classificada em duas formas: a seca ou forma atrófica, e a úmida, também conhecida como neovascular, caracterizada pelo desenvolvimento de uma neovascularização da coroide (NVC).
Apesar de 80% dos pacientes apresentarem a forma seca, a DMRI úmida é responsável por 90% da perda de visão relacionada a esta doença2. A atrofia geográfica (AG) representa o estágio mais avançado da forma seca. O tratamento, que previne deterioração adicional da função visual e confere alguma perspectiva de melhora, só é possível para a forma úmida, através dos agentes antiangiogénicos disponíveis. Até este momento, não existe tratamento para a forma seca.
Ambos, riscos hereditários e ambientais, estão envolvidos no desenvolvimento de DRMI. Tabagismo é o principal fator de risco modificável constantemente identificado2. Os ensaios AREDS demonstraram que suplementação oral diária com vitaminas e minerais antioxidantes, em um grupo específico de pacientes, reduziu em 25% a possibilidade de avanço emergente da DRMI em 5 anos. Estudos genéticos identificaram 19 loci susceptíveis que aparentemente explicam mais de 50% do risco de progressão da DRMI, incluindo polimorfismos únicos no fator de complemento H (FCH) e no ARMS2. Awh et al sugerem que a administração de suplementos antioxidantes seja modificada em certos subgrupos de pacientes, com base em seus genotipos para FCH e ARMS2, porém essa hipótese ainda não está confirmada.
A detecção de NVC antes da ocorrência de danos significativos é fundamental para maximizar desfechos positivos após a terapia antiangiogênica. Lim et al demonstraram que a intervenção tardia resulta em tratamento insuficiente, dano macular irreversível e pior prognóstico. Nesse estudo, um atraso de 14 semanas no diagnóstico dobrou a probabilidade de piora da acuidade visual após o tratamento7.
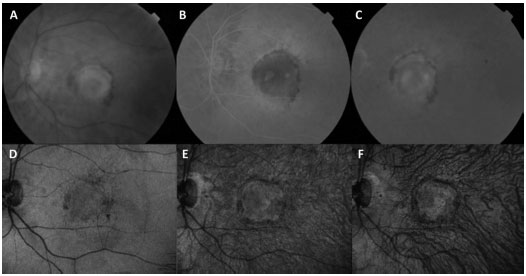
Sob suspeita clínica em uma consulta inicial, torna-se necessária realização de angiografia fluoresceínica (AF), quando a mesma não estiver contraindicada. Ela auxilia o diagnóstico, o planejamento do programa terapêutico e, em associação com a angiografia com indocianina verde (ICGA), pode detectar formas variáveis de DRMI úmida. A proliferação angiomatosa da retina (PAR), conhecida também como NVC tipo 3, caracteriza-se clinicamente por sangramento focal, anormalidades císticas, e exsudados de lipídios na retina. Clinicamente, a vasculopatia polipoidal da coróide (VPC) é difícil de ser distinguida de outras formas de NVC ocultas (NVC tipo 1). Ela ocorre mais comumente recorrente com descolamentos do epitélio pigmentar (DEPs)fí. A AF mostra um padrão oculto similar e a ICGA é capaz de delimitar as alterações polipoidais de forma detalhada (Figura 1).
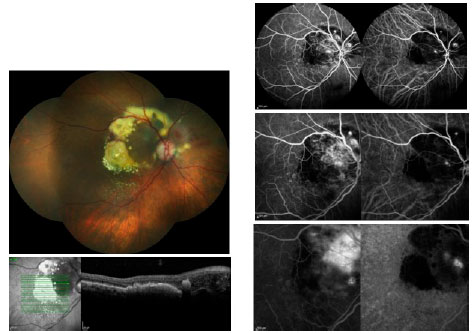
A tomografia de coerência óptica (TCO), utilizada pela primeira vez na década de 90, é sem dúvida a ferramenta mais frequentemente utilizada no controle de longo prazo da DRMI úmida. Comparações da espessura e da morfología macular ao longo do tempo permitem avaliar a resposta do paciente ao tratamento.
No presente artigo, discutiremos o manejo da DRMI, incluindo as opções diagnosticas e terapêuticas disponíveis com base em resultados de estudos relevantes, regimes diferenciados de tratamento e tendências futuras no controle de ambas as formas, seca e úmida, dessa importante doença.
MÉTODOS
Este é um estudo descritivo, objetivando fornecer uma análise abrangente focada em informações atuais do “estado da arte”, além de esclarecer algumas trajetórias futuras plausíveis de abordagem do tratamento e controle da DMRI.
RESULTADOS
Os mediadores da angiogênese e da inflamação, incluindo os fatores de crescimento endotelial (VEGFs), têm um papel importante no desenvolvimento de NVC. A VEGF-A é uma glicoproteína homodimérica de 45 kDa, pertencente à família que inclui também da VEGF-B até a VEGF-E, o fator de crescimento derivado de plaquetas (FCDP) e o fator de crescimento placentário (PIGF). Acredita-se que a VEGF-A seja a proteína proangiogênica mais potente já descrita, induzindo proliferação, brotamento e formações tubulares das células endoteliais. A terapia de injeção intravítrea com agentes antiangiogênicos é a técnica de maior sucesso para o controle da DMRI úmida e constitui a primeira linha de tratamento2.
Existem, atualmente, duas drogas aprovadas pelo FDA americano e pela ANVISA: ranibizumab (Lucentis; Genentech, US) e aflibercept (Eylea; Bayer, Germany). Enquanto aguardavam a aprovação do ranibizumab pelo FDA, os oftalmologistas começaram a tratar a DRMI úmida com 1,25 mg de bevacizumab, pois essa droga tem especificidade alvo similar à do ranibizumab11.
O bevacizumab (Avastin; Genentech, US) é um anticorpo monoclonal humanizado que se liga a todas as isoformas de VEGF. Ele foi desenvolvido para inibir a angiogênese patológica em tumores e é aprovado pelo FDA para tratamento de metástase colorretal. Em oftalmología é uma droga “off label”. Existe uma hipótese que o bevacizumab seja tão eficiente quanto o ranibizumab para o tratamento de DRMI úmida, proporcionando uma alternativa mais econômica que as substâncias aprovadas, especialmente adaptadas para administração intraocular. Em um protocolo de injeções mensais fixas durante 12 meses, o custo projetado do ranibizumab gira em torno de USD$22.000, em comparação a aproximadamente USD$600 para a terapia com bevacizumab14.
A terapia antiangiogênica com 0,5 mg de ranibizumab ficou estabelecida como a base para o manejo da DRMI úmida após a sua aprovação em julho de 200615,16. O ranibizumab é um anticorpo monoclonal de fragmento Fab, recombinante e modificado. O fragmento Fc foi removido da partícula original, que é traduzida por um terço do peso molecular do bevacizumab, uma meia-vida mais curta e, consequentemente, maior segurança e boa penetração na retina após a injeção intravítrea. Além disso, a afinidade do composto para VEGF foi aumentada por modificações de um grupo de aminoácidos.
O aflibercept é uma fusão de proteínas que se ligam ao VEGF-A e ao PIGF, possuindo alta afinidade e eficácia. Os ensaios clínicos VIEW 1 e 2 asseguraram sua aprovação. A porção constante Fc da lgG1 sustenta a configuração da “armadilha” do aflibercept. Além de estabilizar a estrutura da molécula, a porção Fc confere uma meia-vida aceitável no plasma. Injeções intravítreas mensais de aflibercept por 3 meses iniciais, seguidas por um regime bimensal fixo produziram eficácia e segurança semelhantes ao uso mensal de ranibizumab. Entretanto, no estudo VIEW 1, o aflibercept mensal resultou a melhor acuidade visual corrigida (BCVA), estatisticamente superior. Muitos estudos intervencionais sugerem um resultado anatômico superior do aflibercept em comparação ao ranibizumab. A afinidade de ligação do aflibercept intravítreo ao VEGF é maior que a do bevacizumab e do ranibizumab. Essa afinidade pode ser entendida como uma maior eficácia ou, como previsto por um modelo matemático, uma duração da ação intraocular substancialmente mais longa19.
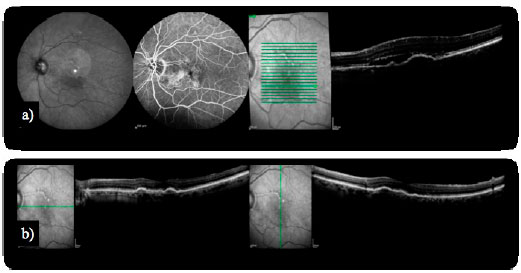
Algumas complicações inerentes à história clínica da DRMI úmida têm sido confrontadas em um espectro adaptado de terapias. O DEP ocorre devido ao seu descolamento da membrana de Bruch subjacente. Estudos prévios demonstraram que DEPs respondem mal aos tratamentos para NVC, incluindo a terapia fotodinâmica (TFD) e os agentes antiangiogênicos. Involuções importantes de DEPs foram observadas com a introdução do aflibercept em pacientes com DRMI refratária (Figura 2). Infelizmente, apesar da redução das dimensões dos DEPs e da espessura da retina central em TCO, não correlação com alterações na visão foi demonstrada20.
Desde os resultados cruciais dos ensaios MARINA e ANCHOR, os protocolos de tratamento foram adaptados às práticas clínicas diárias reais e aos interesses dos pacientes. Indivíduos sob esquemas fixos mensais de injeções de ranibizumab durante 24 meses nesses em ensaios clínicos prévios continuaram por mais 24 meses o programa “PRN” de tratamento com ranibizumab no protocolo HORIZON, observando-se um declínio geral de 8,2 letras durante o período de 7 a 8 anos. Atrofia macular foi o efeito crônico mais proeminentemente observado, presente praticamente em todos os indivíduos. Isso sugere que o distúrbio tenha características de longa duração. Naquela época, não se sabia se protocolos fixos com intervalos mensais representavam a melhor abordagem. Acreditava-se que a necessidade de repetir tratamentos era imprevisível, variando entre os pacientes.
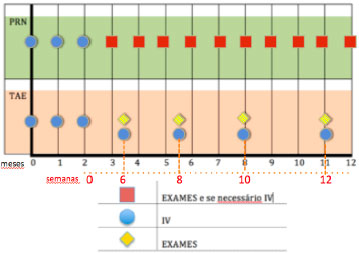
Essa busca resultou em diferentes programas de tratamento, como o “PRN” (também conhecido como ‘se necessário) e o “tratar e estender” (TAE) (Figura 3). É importante ressaltar alguns estudos importantes com o protocolo “PRN”: CATT, PrONTO e HARBOR. Regillo definiu a estratégia TAE como uma dosagem contínua com o objetivo de minimizar recorrências e maximizar desfechos visuais de longo prazo. Ao mesmo tempo, sendo a dose variável e, portanto individualizada, com o potencial de minimizar tratamentos excessivos e suas sobrecargas, e maximizar a segurança. A estratégia variável é também econômica, uma vez que minimiza o número de consultas médicas, testes e injeções.
O ensaio CATT foi um estudo de não inferioridade (NI) que indicou resultados similares com ranibizumab e bevacizumab em regime mensal ou em “PRN”, durante um período de 24 meses. Entretanto, o bevacizumab no regime “PRN” não apresentou o ponto NI, quando comparado ao ranibizumab mensal. O tratamento “PRN” resultou em menor ganho de BCVA, independentemente se instituído no início ou após 12 meses de tratamento mensal. Além dos resultados do CATT, outros ensaios prospectivos, como o IVAN, compararam ambas as drogas em protocolos similares e distintos. Resultados de 24 meses do ensaio IVAN, um estudo europeu similar ao CATT, demonstraram que o bevacizumab não caiu na margem de NI, conforme observado no ensaio CATT, e a redução na frequência de um novo tratamento resultou em pequena perda de eficácia, independentemente da droga.
No estudo PrONTO, o protocolo “PRN” estabelecia a realização de novo tratamento nos primeiros 12 meses, caso a TCO demonstrasse aumento de pelo menos 100 |jm na TCO CRT, ou uma perda de 5 letras. Ao fim de 24 meses, os pacientes melhoraram em até 11,1 letras, com 9,9 injeções ao longo do período, indicando que pacientes inscritos no estudo PrONTO tiveram resultados similares, em comparação com os dos ensaios MARINA e ANCHOR, porém com menor número de injeções. Para o grupo do estudo HARBOR concluiu-se que 2,0 mg de ranibizumab não foi melhor que a dose usual de 0,5 mg, fato inconsistente com os resultados do ensaio SAVE, que demonstraram melhor BCVA em pacientes tratados com dose mais alta . Entretanto, enquanto o ensaio SAVE incluiu pacientes com DMRI úmida recalcitrante, o HARBOR recrutou indivíduos em tratamento ingênuo. Além de comparar o ranibizumab em regime mensal fixo e em um regime “PRN” flexível, o estudo HARBOR foi o primeiro ensaio no qual os investigadores utilizaram a tecnologia SD OCT, proporcionando uma ‘histología’ ótica de alta resolução. De acordo com os resultados do ensaio TURF, pacientes com a forma úmida recalcitrante, já em tratamento com 2,0 mg de ranibizumab, mantiveram melhora anatômica significativa com 2,0 mg de aflibercept, geralmente em um programa mensal.
Spaide e Freund foram os primeiros a descrever um protocolo “tratar e estender”, e seus grupos publicaram subsequentemente dois pequenos estudos retrospectivos mostrando bons resultados visuais. O programa “TAE” permite um algoritmo individualizado de tratamento. Atualmente, esse é o tratamento mais comumente utilizado nos Estados Unidos, de acordo com um levantamento feito em 2014 entre os membros da Sociedade Americana de Especialistas em Retina (American Society of Retina Specialists 2014 Membership Survey: Preferences and Trends), que registrou resultados similares aos obtidos em 2013, com aproximadamente 77,8% dos especialistas em retina a favor dessa forma de procedimento para a DMRI úmida. O esquema consiste de três injeções iniciais mensais, seguidas por um programa específico de injeções subsequentes, até que a deteriorização seja evidente. A manutenção das injeções é considerada um atributo importante da “TAE” algorítmica, para certificar a estabilidade do distúrbio e minimizar danos estruturais que venham ocorrer em conseqüência da recorrência da atividade da NVC (Figura 4).
DISCUSSÃO
O benefício da terapia antiangiogênica está estabelecido como a principal linha de tratamento da DMRI úmida. Infelizmente, uma parte significativa de pacientes é ainda diagnosticada com fibrose subretinal, indicando que o diagnóstico inicial é crucial para a obtenção de melhores resultados.
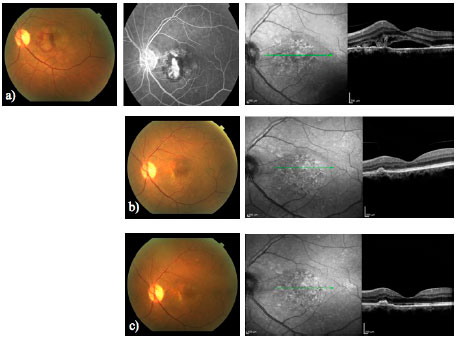
Os avanços de técnicas por imagem permitem analisar de forma apropriada as anormalidades da retina. A tecnologia da TCO avançou desde a sua primeira descrição e alguns desses avanços podem constituir ferramentas auxiliares na prática clínica. A TCO EN FACE permite uma vista coronal do segmento posterior em distintos níveis. A fonte de varredura da TCO (TCO SS) utiliza uma onda mais longa (1050 nm) que a TCO de domínio temporal (TCO DT) ou a TCO de domínio espectral (OCT DE). Isso representa uma vantagem para o estudo da coroide. A alta velocidade de leitura também captura imagens em um período de tempo mais curto, aumentando a possibilidade de obtenção de fotografias de maior resolução. Publicações recentes demonstram suas aplicações e a correlação entre a angiografia e a TCO SS EN FACE na DMRI úmida, que podem proporcionar melhor entendimento de sua patofisiologia, auxiliando, assim, no manejo de nossos pacientes (Figura 5)28.
O monitoramento “at home” tem sido também discutido. O PHP tem mostrado alta sensibilidade na detecção de NVC. O estudo HOME observou que além de apresentarem menor perda de visão no momento da NVC, os participantes alocados na estratégia de monitoramento em casa mantiveram também melhor BCVA que os demais pacientes.
Parece existir uma lacuna entre a rotulagem das drogas disponíveis para o tratamento da DRMI úmida e suas efetivas aplicações na prática clínica. Objetivando melhorias de abordagem, além de injeções com agentes antiangiogênicos disponíveis, existe um grupo de estratégias alternativas potenciais, algumas delas ainda em investigação. A combinação terapêutica de agentes antiangiogênicos e radiação ionizante é referenciada como uma outra opção para reduzir a frequência de tratamentos31. Avila et al observaram, após 12 meses, um ganho de acuidade visual de 8,9 letras, com 91% dos pacientes mantendo a visão e 68% demonstrando visão estável ou melhor. Além disso, 70% dos pacientes não necessitaram de injeção anti-VEGF adicional. A terapia de combinação farmacológica tem sido também mencionada. Um inibidor do FCDP, denominado Fovista (E10030, Ophthotech) tem sido investigado como uma terapia combinada com um agente anti-VEGF. Em um relato inicial, a combinação terapêutica atingiu o ponto final primário de superioridade sobre a monoterapia com agente anti-VEGF, demonstrando um benefício adicional de 62% em todos os pontos temporais. A busca por uma droga melhor está em andamento33.
Desconsiderando-se a formulação AREDS, não existe ainda uma opção aprovada para o tratamento de DMRI seca. A patofisiologia desse distúrbio mostra que o processo de envelhecimento representa danos para o RPE, que se torna incapaz de lidar com o metabolismo fotorreceptor. Com o tempo, o RPE, os fotorreceptores e finalmente os capilares da coroide degeneram determinando a AG34. A terapia com células-tronco (SC) representa urna nova abordagem através da qual doenças degenerativas da retina podem ser tratadas por substituição ou suplementação dos RPEs ou fotorreceptores danificados. Células embrionárias humanas (hESC) e pluripotentes induzidas (iPSC) constituem, no momento, as principais formas de terapia de retina com SC. Schwartz e colaboradores publicaram em 2012, dados preliminares do primeiro paciente com AG tratada com RPE derivado de hESC. Apesar da perspectiva de avanços significativos com o uso dessa terapia, aspectos importantes precisam ainda ser abordados para a obtenção dos próximos resultados positivos24.
No momento, duas estratégias visando prevenir a progressão da DMRI seca estão sob investigação clínica: a modulação do ciclo visual, para prevenir perdas do fotorreceptor e do RPE, e a inibição do complemento. A primeira modalidade é representada pelo Emixustat HCI (ACU-4429, Acúcela), um modulador do ciclo visual administrado oralmente, que foi desenvolvido para inibir a atividade de uma isomerase (RPE65), reduzindo o nível de vitamina A processada no ciclo visual. A RPE65 tem sido explorada como um alvo terapêutico potencial em modelos pré-clínicos desde início da década de 2000. O lampalizumab, um anti-fator D (Genentech), é um inibidor seletivo da via alternativa do complemento. O lampalizumab é um fragmento de ligação de antígeno de um anticorpo monoclonal humanizado que inibe o fator D do complemento, bloqueando a ativação da via alternativa do complemento. Observou-se redução de 20% de AG, 18 meses após a injeção de 10 mg de lampalizumab36. Regillo e colaboradores apresentaram, em 2013, os resultados do estudo MAHALO no encontro anual da AAO (2013 Retina Subspecialty Day of the AAO Annual Meeting).
A squalamina (Ohr Pharmaceutical) é uma opção tópica que inibe o VEGF e o FCDP, além do fator de crescimento fibroblástico (bFGF), objetivando reduzir o número de injeções anti-VEGF necessárias, porém ainda sem aprovação. Uma publicação recente relata um estudo comparando a formulação ocular tópica de pazopanib, uma terapia auto administrável para DRMI úmida, com a monoterapia com ranibizumab. O pazopanib é um inibidor multialvo da tirosina quinase que inibe receptores de VEGF1,2,3, bem como a via do FCDP. Um estudo prévio demonstrou que a instilação tópica ocular de pazopanib “TID” foi associada a melhorias de BCVA em indivíduos com NVC subfoveal secundária à DMRI. O pazopanib foi bem tolerado. Gotas diárias de pazopanib em pacientes com DMRI úmida não resultou em benefícios terapêuticos além daqueles obtidos apenas com ranibizumab38.
Em conclusão, apesar dos avanços notáveis e contínuos do tratamento da DRMI úmida com terapia antiangiogênica, os pacientes ainda necessitam de várias injeções e consultas médicas. Entretanto, terapias futuras têm grande potencial não apenas de reduzir consultas e injeções, mas também de melhorar os desfechos através da busca de vias adicionais31. Contudo, sendo a DMRI um distúrbio crônico, independentemente da estratégia de tratamento utilizada, existe um consenso de que os melhores resultados serão alcançados com detecção e tratamento precoces. O objetivo da escolha terapêutica deve ser a redução de crescimento da NVC e a manutenção da melhor visão possível dos pacientes por um longo período de tempo.
REFERÊNCIAS
1 Finger RP, Wickremasinghe SS, Baird PN, Guymer RH. Preditores de resposta ao tratamento anti-VEGF na degeneração macular neovascular relacionada à idade. Levantamento Oftalmológico. 2014;59(1):1 -18.
2 Padrão de Práticas Recomendadas pela Academia Americana de Oftalmologia (PPP - AAO) para a Degeneração Macular Relacionada à Idade. http://one.aao.ora/preferred-practice-pattern/aae-related-macular-deaeneration-ppp-2Q15. 2015.
3 Schmidt-Erfurth U, Chong V, Loewenstein A, Larsen M, Souied E, Schlingemann R, et al. Diretrizes da Sociedade Européia de Especialistas em Retina (EURETINA) para o manejo da degeneração macular neovascular relacionada à idade. Revista Britânica de Oftalmologia. 2014;98(9):1144-67.
4 Grupo de Estudos sobre Doenças Oculares Relacionadas à Idade (estudo 2). Luteína + zeaxantina e ácidos graxos omega-3 para a degeneração macular relacionada à idade: ensaio clínico randomizado do estudo 2 (AREDS2) de Doenças Oculares Relacionada à idade. Jama (Revista da Associação Médica Americana). 2013;309(19):2005-15.
5 Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, Grupo S-USA. Resultados em pacientes após de tratamento com ranibizumab nos estudos ANCHOR, MARINA e HORIZON: um estudo de coorte multicêntrico (SEVEN-UP). Oftalmologia. 2013;120(11):2292-9.
6 Chew EY, Klein ML, Clemons TE, Agron E, Ratnapriya R, Edwards AO, et al. Ausência de associação clínica significativa entre os genotipos CFH e ARMS2 e resposta a suplementos nutricionais: relatório AREDS número 38. Oftalmologia. 2014;121 (11):2173-80.
7 Faes L, Bodmer NS, Bachmann LM, Thiel MA, Schmid MK. Acurácia diagnostica da Tela de Amsler e do perímetro de hiperacuidade preferencial na triagem de pacientes com degeneração macular relacionada à idade: revisão sistemática e meta-análise. Olho. 2014;28(7):788-96.
8 Khan S, Engelbert M,Imamura Y, Freund K. Vasculopatia polipoidal da coroide: Achados da Angiografia com Indocianina Verde de forma Simultânea e Rastreamento Ocular pela Tomografia de Coerência Óptica com Domínio Espectral. RETINA 2012; 32:1057-1068.
9 Keane PA, Patel PJ, Liakopoulos S, Heussen FM, Sadda SR, Tufail A. Avaliação da degeneração macular relacionada à idade pela tomografia de coerência ótica. Levantamento Oftalmológico. 2012;57(5):389-414.
10 de Oliveira Dias JR, Rodrigues EB, Maia M, Magalhaes O, Jr, Penha FM, Farah ME. Citoquinas em degeneração macular neovascular relacionada à idade: fundamentos da terapia combinada alvo. Revista Britânica de Oftalmologia. 2011 ;95(12):1631 -7.
11 Grupo de Pesquisas CATT. Ranibizumab e Bevacizumab para Degeneração Macular Neovascular Relacionada à Idade. Rev Med N Engl. 2011 ¡364(20)1897-1908.
12 Kodjikian L, Souied EH, Mimoun G, Mauget-Faysse M, Behar-Cohen F, Decullier E, et al. Ranibizumab versus Bevacizumab para a Degeneração Macular Neovascular Relacionada à Idade: Resultados do ensaio randomizado de não inferioridade GEFAL. Oftalmologia. 2013;120(11):2300-9.
13 Chakravarthy U, Harding SP, Rogers CA, Downes SM, Lotery AJ, et al. Ranibizumab versus bevacizumab para o tratamento da degeneração macular relacionada à idade: achados de um ano do ensaio randomizado IVAN. Oftalmologia. 2012;119(7):1399-411.
14 Jeng KW, Wilgucki J, Halperin S et al. ESPECIALISTAS EM RETINA RECOMENDAM PARA OS PACIENTES ABORDAGENS DIFERENTES DAS QUE ELES ESCOLHERIAM PARA SEU PRÓPRIO TRATAMENTO DE DEGENERAÇÃO MACULAR RELACIONADA À IDADE Retina 2014; 34:1796-1801.
15 Rosenfeld PJ, Heier JS et al. Ranibizumab para degeneração macular neovascular relacionada à idade. Rev Med N Engl. 2006(355):12.
16 Brown D KP, Michels M et al. Grupo de estudos ANCHOR. Ranibizumab versus Verteporfin para degeneração macular neovascular relacionada à idade. Rev Med N Engl. 2006(355): 1432-44.
17 Heier JS, Brown DM, Chong V, Korobelnik JF, Kaiser PK, Nguyen QD, et al. Aflibercept intravítreo (Armadilha-Olho de VEGF) na forma úmida de degeneração macular relacionada à idade. Oftalmologia. 2012;119(12):2537-48.
18 Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, Brown DM, Chong V, Nguyen QD, et al. Injeções intravitreas de flibercept para a degeneração macular neovascular relacionada à idade: resultados de noventa e seis semanas de estudos VIEW. Oftalmologia. 2014;121 (1):193-201.
19 Arcinue CA, Ma F, Barteselli G, Sharpsten L, Gomez ML, Freeman WR. Resultados de um ano de aflibercept para degeneração macular neovascular relacionada à idade recorrente ou persistente. Revista Americana de Oftalmologia. 2015;159(3):426-36 e2.
20 Broadhead G, Hong T, Zhu M et al. RESPOSTA DE DESPRENDIMENTOS DO EPITÉLIO PIGMENTÁRIO AO AFLIBERCEPT INTRAVÍTREO ENTRE PACIENTES COM DEGENERAÇÃO MACULAR NEOVASCULAR RELACIONADA À IDADE RESISTENTE A TRATAMENTO. Retina 2014; 0:1-7.
21 Grupo de Pesquisas Comparativas de Ensaios de Tratamento da Degeneração Macular Relacionada à idade, Martin DF, Maguire MG, Fine SL, Ying GS, Jaffe GJ, et al. Ranibizumab e bevacizumab para tratamento da degeneração macular neovascular relacionada à idade: resultados de dois anos. Oftalmologia. 2012;119(7):1388-98.
22 Bhisitkul RB, Mendes TS, Rofagha S, Enanoria W, Boyer DS, Sadda SR, et al. Progressão da Atrofia Macular e 7 anos de Resultados Visuais em Indivíduos dos Estudos ANCHOR, MARINA e HORIZON: o Estudo SEVEN-UP. Revista Americana de Oftalmologia. 2015.
23 Lalwani GA, Rosenfeld PJ, Fung AE, Dubovy SR, Michels S, Feuer W, et al. Regime de dose variável de ranibizumab intravítreo para a degeneração macular neovascular relacionada à idade: ano 2 do estudo PrONTO. Revista Americana de Oftalmologia. 2009;148(1):43-58 e1.
24 Ho AC, Busbee BG, Regillo CD, Wieland MR, Van Everen SA, Li Z, et al. Eficácia de vinte e quarto meses e segurança do ranibizumab a 0,5 mg ou 2,0 mg em pacientes com degeneração macular neovascular relacionada à idade. Oftalmologia. 2014;121 (11 ):2181 -92.
25 Wykoff CC, Brown DM, Croft DE, Wong TP. Resultados de Dois Anos do SAVE: ranibizumab a 2,0 mg para DMRI neovascular recalcitrante. Oftalmologia. 2013;120(9):1945-6 e1.
26 Wykoff CC, Brown DM, Maldonado ME, Croft DE. Tratamento com aflibercept para a degeneração macular relacionada à idade exsudativa em pacientes com resposta incompleta a injeções múltiplas de ranibizumab (ensaio TURF). Revista Britânica de Oftalmologia. 2014;98(7):951 -5.
27 Rayess N, Houston SK, 3rd, Gupta OP, Ho AC, Regillo CD. Resultados após 3 anos de tratamento da degeneração macular neovascular relacionada à idade utilizando o regime ‘tratar e estender’. Revista Americana de Oftalmologia. 2015;159(1 ):3-8 e1.
28 Flores-Moreno I, Arias-Barquet L, Rubio-Caso MJ, Ruiz-Moreno JM, Duker JS, Caminal JM. Tomografia de coerência ótica com fonte de varredura ‘En face’ na degeneração macular neovascular relacionada à idade. Revista Britânica de Oftalmologia. 2015.
29 Isaac D, Ávila M, Cialdini A. Comparação da T de Amsler original com o perímetro de hiperacuidade preferencial para detecção de neovascularização da coroide na degeneração macular relacionada à idade. Arq Bras Oftalmol. 2007;70(5):771 -6.
30 Group AHSR: Chew EY, Clemons TE, Bressler SB, Elman MJ, Danis RP, et al. Ensaio randomizado de um sistema de monitoramento em casa para detecção precoce de neovascularização da coroide, estudo de monitoramento do olho em casa (HOME). Oftalmologia. 2014;121(2):535-44.
31 Kaiser P. Terapias emergentes para a degeneração macular neovascular relacionada à idade: drogas em fase de preparação. Oftalmologia. 2013;120(5 Supl):S11 -5.
32 Ávila MP, Farah ME, Santos A, Duprat JP, Woodward BW, Nau J. Segurança de curto prazo de doze meses e resultados de acuidade visual de um estudo prospectivo multicêntrico de braquiterapia epiretinal de estróncio-90 com bevacizumab para o tratamento de neovascularização subfoveal coroidal secundária à degeneração macular relacionada à idade. Revista Britânica de Oftalmologia. 2009;93(3):305-9.
33 Tolentino MJ, Dennrick A, John E, Tolentino MS. Drogas em ensaios clínicos de Fase II para o tratamento da degeneração macular relacionada à idade. Opinião de especialista em investigação de drogas. 2015;24(2):183-99.
34 Chakravarthy U, Soubrane G, Bandello F, Chong V, Creuzot-Garcher C, Dimitrakos SA, 2nd, et al. Evolução das diretrizes europeias para o controle da degeneração macular neovascular relacionada à idade. Revista Britânica de Oftalmologia. 2006;90(9):1188-96.
35 Kvanta A, Grudzinska MK. Tratamento baseado em células tronco para a atrofia geográfica: promessas e imprevistos. Ata Oftalmológica. 2014;92(1):21-6.
36 Garcia JM, Mendonça L, Brant R, Abud M, Regatieri C, Diniz B. Terapia de células tronco para doenças da retina. Rev Mundial Cel Tronco 2015; 7(1): 158-162.
37 Holz FG, Strauss EC, Schmitz-Valckenberg S, van Lookeren Campagne M. Atrofia geográfica: características clínicas e abordagens terapêuticas potencias. Oftalmologia. 2014;121 (5):1079-91.
38 Csaky KG, Dugel PU, Pierce AJ, Fries MA, Kelly DS, Danis RP, et al. Avaliação Clínica do Pazopanib em Gotas Oculares versus Injeções Intravítreas de Ranibizumab em Indivíduos com Degeneração Macular Neovascular Relacionada à Idade. Oftalmologia. 2015;122(3):579-88.

Fonte de financiamento: declaram não haver.
Conflito de interesses: declaram não haver.
Recebido em:
23 de Abril de 2015.
Aceito em:
18 de Maio de 2015.