André Mózena1; Guilherme Henrique Tanajura2; Maria de Fátima de Carvalho Ferreira3; Jair Giampani Júnior2; Marcial Francis Galera3,4
DOI: 10.17545/eOftalmo/2023.0009
RESUMO
OBJETIVO: Identificar alterações oftalmológicas em uma amostra de crianças com síndrome congênita por zika vírus do município de Cuiabá, correlacionar esses achados com a infecção congênita por zika vírus e apresentar o quadro clínico apresentado pelas mães das crianças avaliadas.
MÉTODOS: Este estudo é um relato de série de casos, observacional, descritivo.
RESULTADOS: Foram examinadas 29 crianças entre março de 2019 e março de 2020, das quais 3 foram excluídas após confirmação diagnóstica de citomegalovirose durante a revisão de prontuário. A idade média das crianças foi de 2,21 ±0,79 anos. Quinze das 26 crianças eram do sexo feminino. A maioria das mães (57,69%) referiu sintomas durante a gestação. Microcefalia esteve presente em 73,08% das crianças (19/26) e, desses pacientes, 55,26% de seus olhos apresentou algum grau de alteração estrutural. A média de equivalente esférico da amostra foi de +0,49 ± 2,13 dioptrias. A pressão intraocular média foi de 14 ± 2,59 mmHg. A média do diâmetro corneal foi de 11,36 ± 0,72 mm. A espessura de córnea central mostrou valor médio de 568,33 ± 46,21 µm. O diâmetro ântero-posterior médio foi de 21,08 ± 1,21 mm.
CONCLUSÃO: A frequência de achados oftalmológicos por síndrome congênita por Zilka Virus foi semelhante à de outros estudos. Alterações fundoscópicas foram encontradas em 46,15% dos olhos examinados. Outras anormalidades oculares também foram muito prevalentes, como erros refrativos, nistagmo e estrabismo. Os dados biométricos oculares (diâmetro corneal, diâmetro ântero-posterior, espessura da córnea central) foram normais em relação à população saudável da mesma faixa etária.
Palavras-chave: Oftalmologia; infecção por Zika vírus; manifestações oculares; Microcefalia; síndrome congênita de Zika; Doença por Zika vírus.
ABSTRACT
PURPOSES: To identify ophthalmological changes in children with congenital Zika virus syndrome residing in the city of Cuiabá; to correlate these findings with congenital Zika virus infection; and to present the clinical profile of the mothers of those children.
METHODS: This study was an observational, descriptive case series.
RESULTS: A total of 29 children were examined between March 2019 and March 2020. Of those, three were excluded after diagnostic confirmation of cytomegalovirus during the medical record review. Of the remaining 26 children, 15 and 11 were females and males, respectively. The average age of the children was 2.21 ± 0.79 years. Most mothers (57.69%) reported symptoms during pregnancy. Microcephaly was present in 73.08% of the children (19/26); among them, some degree of structural alteration was observed in 55.26% of the examined eyes. The average spherical equivalent of the sample was +0.49 ± 2.13 diopters. The average intraocular pressure was 14 ± 2.59 mmHg. The mean corneal diameter was 11.36 ± 0.72 mm. The average central corneal thickness was 568.33 ± 46.21 µm. The mean anteroposterior diameter was 21.08 ± 1.21 mm.
CONCLUSION: The frequency of ophthalmic effects induced by Zika virus was similar to that reported in other studies. Fundus changes were found in 46.15% of the examined eyes. Other ocular abnormalities (e.g., refractive errors, nystagmus, and strabismus) were also highly prevalent. The ocular biometric data (i.e., corneal diameter, anteroposterior diameter, central corneal thickness) in these children were normal in relation to the healthy population of the same age group.
Keywords: Ophthalmology; Eye manifestations; Microcephaly; Congenital Zika syndrome; Congenital Zika virus infection.
INTRODUÇÃO
O vírus Zika (VZK) é um vírus de RNA da família Flaviviridae, gênero Flavivirus, relacionado aos vírus da dengue, chikungunya, febre amarela e febre do Nilo Ocidental. O vírus leva o seu nome da Floresta Zika em Uganda, onde foi identificado pela primeira vez1,2. Em 1952, o VZK foi isolado em humanos, em Uganda e na Tanzânia1. O principal vetor de transmissão urbana é o mosquito Aedes aegypti. A transmissão se dá via transplacentária e/ou leite materno humano, bem como por meio de relações sexuais, transfusão de sangue e transplantes de órgãos3-5.
Desde a identificação do vírus, na década de 1940, até 2007, houve apenas relatos esporádicos de casos de infecção pelo VZK, sem grandes repercussões no meio médico e científico, apesar de sua ampla distribuição geográfica na África e Ásia6.
Em 2007 e 2013, nas ilhas Yap7 e na Polinésia Francesa8, respectivamente, ocorreram os primeiros grandes surtos de infecção pelo VZK. Desde então, há relatos de infecção pelo VZK em várias ilhas do Pacífico Sul9, no Japão, na Austrália, Alemanha, França e Noruega, demonstrando a grande capacidade do VZK de se alastrar para áreas onde o vírus não é endêmico mas onde o mosquito vetor pode estar presente10.
Os primeiros casos de infecção pelo VZK no Brasil foram identificados em 2015, no estado da Bahia. Entretanto, o estado de Pernambuco apresentou o maior número de casos11. Estima-se que um milhão de brasileiros tenham sido infectados em 201512. Concomitantemente aos casos de infecção pelo VZK no Brasil, observou-se que os casos de microcefalia congênita aumentaram 20 vezes, totalizando 1.248 casos em 2015, com uma prevalência de 99,77 por 100.000 nascidos vivos. Exames do líquido amniótico de gestantes com fetos com microcefalia e de tecido de um recém-nascido com microcefalia que morreu após o nascimento, mostraram a presença do VZK13. A relação causal entre infecção materna por VZK e microcefalia foi considerada14.
A fisiopatologia das lesões apresentadas por esses lactentes ainda não está totalmente esclarecida, mas pode estar relacionada à ação direta do vírus e/ou de uma toxina viral que pode levar a uma reação inflamatória, resultando em anormalidades conhecidas, incluindo danos oculares14. Estudos sugerem que o VZK possui um neurotropismo para as células progenitoras neurais humanas, o que explicaria porque as alterações neurológicas são mais comuns em fetos do que em adultos15-17.
Singh et al.18 levantaram a hipótese de que o VZK, sendo um vírus transmitido pelo sangue, atingiria primeiro as células das barreiras hemato-retinianas externa e interna que expressariam receptores para a entrada do vírus, bem como permitiriam sua replicação intracelular, servindo como reservatórios e facilitando a disseminação viral para outros órgãos.
Os sintomas nos adultos são semelhantes ao quadro da dengue, consistindo em erupção cutânea, febre baixa, mialgia, conjuntivite não purulenta, artralgia, prurido e mal-estar. Esses sintomas são frequentemente autolimitados e persistem por aproximadamente 4 a 7 dias19, mas a maioria dos adultos é assintomática9.
As anormalidades que fazem parte do quadro de infecção congênita pelo VZK são graves, com microcefalia congênita, desproporção craniofacial, espasticidade, crises epilépticas, irritabilidade, disfunções do tronco encefálico (como problemas de deglutição), artrogripose, anormalidades auditivas e oculares e sintomas piramidais e extrapiramidais. É muito comum observarem-se anormalidades cerebrais em estudos de imagem, tais como calcificações corticais e subcorticais, malformações corticais, hipoplasia do tronco cerebral e cerebelo, ventriculomegalia, perturbação na migração neuronal e padrão simplificado de giros cerebrais20-23.
Os achados oculares ocorrem em até 50% das crianças com microcefalia em decorrência da síndrome congênita do virus Zika (SCZ)1. As alterações oftalmológicas já descritas em pacientes com microcefalia por SCZ são: atrofia macular e coriorretiniana periférica, alterações pigmentares na região central e periférica da retina, atenuação vascular, atrofia óptica, hipoplasia do disco óptico, aumento da razão escavação/disco, coloboma da íris e subluxação do cristalino.
Estudos subsequentes24 constataram que os achados oculares, bem como a gravidade desses achados, estão diretamente relacionados ao estágio de desenvolvimento fetal em que ocorre a infecção. Assim, infecções durante o primeiro e segundo trimestre de gravidez tendem a causar alterações oculares mais frequentes e mais severas20. Outros fatores, como a carga viral, a resposta imune da mãe e do feto e outros fatores ainda não conhecidos, podem desempenhar um papel importante nas alterações observadas nos recém-nascidos17-22. Portanto, a gravidade da infecção materna provavelmente tem influência direta na gravidade da infecção no feto ou recém-nascido23.
O conhecimento dos dados biométricos oculares, do estado refrativo e como eles se alteram com a idade é essencial para que o crescimento do olho e o desenvolvimento de doenças oculares sejam compreendidos24-25. Entretanto, existem poucos estudos com base na população que fornecem informações normativas sobre dados biométricos do olho e sobre refração ocular em crianças26,27.
Neste estudo apresentamos as características oftalmológicas de crianças com SCZ, bem como os dados clínicos das mães.
MÉTODOS
Trata-se de um estudo observacional e descritivo de uma série de casos que seguiu os princípios da Declaração de Helsinki.
Foi usada uma amostra de crianças com SCZ confirmada ou suspeita entre março de 2019 e março de 2020. Essas crianças foram avaliadas no ambulatório de Oftalmologia do Hospital Universitário Júlio Müller (HUJM) da Universidade Federal de Mato Grosso (UFMT).
O critério de diagnóstico dos casos confirmados ou suspeitos de infecção materna pelo VZK se baseou nas condições clínicas e/ou laboratoriais (sorologia, RT-PCR). O critério de diagnóstico de infecção congênita pelo VZK levou em conta a presença de quadro clínico e radiológico compatível após exclusão de outras infecções, e também sorologia e testes moleculares positivos para VZK, bem como as características clínicas apresentadas pelas mães durante a gravidez. Foram consideradas microcefálicas as crianças com medida do perímetro cefálico inferior a 2 desvios-padrão para idade gestacional e sexo, mensurado nas primeiras 48 horas de vida21.
Após anamnese dirigida, foi realizada biomicroscopia do segmento anterior com lâmpada de fenda Topcon® (Topcon Corporation, Japão). Foram realizados teste de estrabismo e exame de motilidade ocular usando uma fonte de luz focal.
Em seguida, foi iniciada cicloplegia pouco antes do paciente ser encaminhado para a sala de cirurgia, onde foi sedado, para que a refração pudesse ser realizada sob cicloplegia. Posteriormente, foram adquiridos valores de pressão intraocular (PIO) utilizando o tonômetro de Perkins® (Clement Clarke International Limited, Inglaterra), valores de diâmetro corneano horizontal (DCH) e diâmetro corneano vertical (DCV) com compasso oftalmológico, valores de terapia fotodinâmica (TPD) e da espessura corneal central (ECC) com o paquímetro AL-4000 Bio & Pachymeter® (Tomey Corporation, Japão). Foi também realizada fundoscopia binocular indireta.
Os valores de refração sob cicloplegia28,29 foram transformados em seus equivalentes esféricos (EE) correspondentes. O erro de refração foi definido como EE ≤-0,75 dioptrias (D) ou ≥+1,50 D. Anisometropia foi definida como uma diferença nos EE entre os olhos ≥1,00 D.
RESULTADOS
Vinte e seis crianças com diagnóstico confirmado ou presumido de SCZ foram avaliadas. A média de idade foi de 2,21 ± 0,79 anos, variando de 8 meses a 4 anos, sendo 15 crianças do sexo feminino (57,69%).
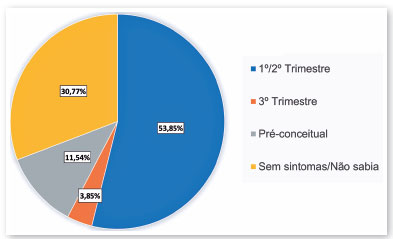
O momento provável da infecção pelo virús Zika durante a gravidez, com base nos sintomas percebidos pelas mães, aconteceu no 1º ou 2º trimestre da gestação em 53,85% dos casos (14/26) e no 3º trimestre da gestação em 3,85% dos casos (1/26), e 30,77% (8/26) dos casos das mães não souberam informar. Inesperadamente, 11,54% (3/26) das mães dos pacientes declararam sintomas no período anterior à concepção (Figura 1).
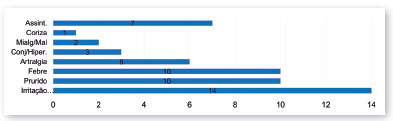
Em relação ao quadro clínico relatado pelas mães, os sintomas mais comuns foram: exantema, prurido, febre e artralgia (Figura 2). Três mães relataram sintomas percebidos no período pré-gestacional.
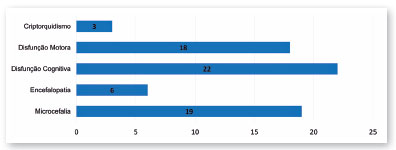
Dezenove crianças (73,08%) apresentaram microcefalia; 23,08% (6/26) tinham alguma outra encefalopatia (calcificações intracranianas, redução do volume cerebral, ventriculomegalia, agenesia do corpo caloso, e esquizencefalia com polimicrogiria); 84,62 (22/26) apresentaram algum grau de disfunção cognitiva; e 69,23% (18/26) tinham algum grau de disfunção motora (Figura 3).
Em relação à movimentação ocular intrínseca, três crianças apresentaram diminuição dos reflexos consensual e fotomotor direto em ambos os olhos, associada à presença de midríase média em duas delas. Uma criança apresentou anisocoria e reflexo fotomotor direto diminuído unilateralmente. Foi identificada ceratopatia puntiforme da córnea do olho esquerdo (OE) em uma criança e blefarite em outra.
A refração realizada sob cicloplegia apresentou um equivalente esférico médio de +0,49 ± 2,13 D (-10,00 a +6,50 D) em os 52 olhos das 26 crianças examinadas. Dos 52 olhos, 28 (53,85%) apresentaram EE na faixa de -0,50 D e +1,25 D. Onze olhos foram caracterizados como míopes e 13 como hipermetrópicos e outros dois pacientes apresentaram anisometropia.
A PIO média foi de 14 ± 2,59 mmHg (09-19 mmHg) em ambos os olhos (AO), medida pela manhã, entre 8h00 e 10h30.
Em relação aos achados de fundo de olho, metade das crianças apresentou alguma alteração: dez em AO e três em apenas um olho. Portanto, do total de 52 olhos, 23 apresentaram alterações de fundo de olho, o equivalente a 44,23% dos olhos examinados. Contabilizando apenas os pacientes com microcefalia (19/26), esse percentual sobe para 55,26% (21/38) dos olhos examinados.
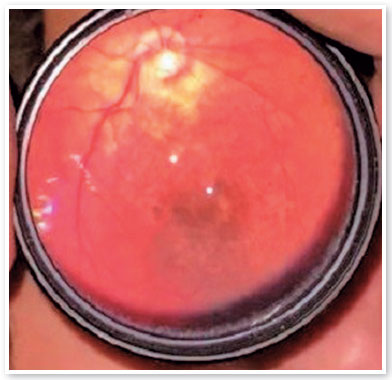
Apareceram lesões cicatriciais de coriorretinite macular em 7,69% dos olhos (4 em 52 olhos). Um olho (1,92%) apresentava cicatriz de coriorretinite na retina periférica.
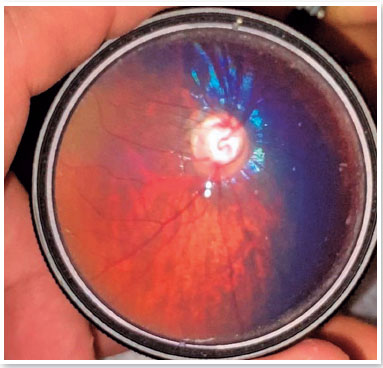
Alterações no epitélio pigmentar da retina (EPR), na mácula, ou na retina periférica foram encontradas em 15,38% dos olhos (8/52) (Figura 4). Alterações no disco óptico, como aumento da escavação e palidez do quadrante temporal (não relacionado à cicatriz de coriorretinite macular), ocorreram em 21,15% (11/52) dos olhos (Figura 5). Em particular, apenas duas crianças apresentaram escavação papilar aumentada (criança BVCS com 0,8 a 0,9 em AO, e criança MRFC com 0,7 em AO). BVCS apresentou PIO de 19 mmHg em AO, ECC de 710 µm no OD e 706 µm no OE, e tanto o defeito pupilar aferente (DPA) quanto os diâmetros da córnea se apresentaram normais. A criança MRFC apresentou ECC de 559 µm no OD e 567 µm no OE, mas suas PIOs foram de 11 mmHg e 10 mmHg no OD e OE, respectivamente. As demais crianças apresentaram escavações papilares iguais ou menores que 0,6. Metade desses olhos (26/52) não apresentou qualquer alteração ao exame de fundo de olho.
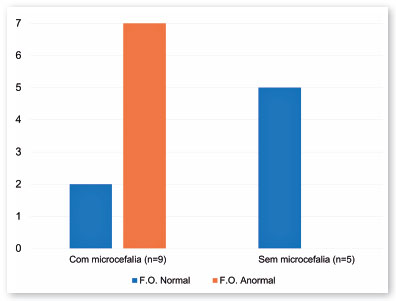
Catorze crianças tiveram infecção intrauterina por VZK durante o 1º ou 2º trimestre. Metade delas (7/14) apresentou microcefalia associada a alterações de fundo de olho, equivalente a 13 dos 28 olhos. Mesmo assim, cinco dessas 14 crianças não apresentaram microcefalia e o exame de fundo de olho estava normal (Figura 6).
Quanto ao diâmetro da córnea, o valor médio foi de 11,36 ± 0,72 mm (10,00-13,00 mm).
A ECC apresentou um valor médio de 568,33 ± 46,21 µm (482,00-710,00 µm) para AO e a média do DPA foi de 21,08 ± 1,21 mm (18,36-24,19 mm). Estes resultados estão detalhados na Tabela 1.
Outras alterações foram identificadas no exame oftalmológico. A presença de nistagmo e alteração do alinhamento ocular chamaram a atenção. No presente estudo, cinco das 26 crianças (19,23%) apresentaram nistagmo, quatro das quais tiveram infecção intrauterina por VZK no 1º ou 2º trimestre de gestação. O estrabismo esteve presente em 53,85% (14/26) das crianças, sendo sete delas infectadas nos dois primeiros trimestres gestacionais.
DISCUSSÃO
Os sintomas presentes em adultos não são específicos da infecção por VZK, sendo o quadro clínico semelhante ao da dengue e, às vezes, até mesmo semelhante a uma infecção de vias aéreas superiores. Consequentemente, a maioria dos casos pode passar despercebida pelos pacientes afetados. Isso sem falar nos pacientes assintomáticos ou oligossintomáticos, que representam a maioria dos casos1. Embora neste estudo a incidência de sintomas nas mães dos pacientes tenha sido maior do que aquela descrita na literatura, houve uma grande variação nesses valores devido à dificuldade de diagnóstico dada a semelhança dos sintomas da infecção por VZK com os de outros arbovírus e de quadros gripais. Esses valores mais elevados também podem refletir uma tendência da SCZ ocorrer com maior frequência em mães sintomáticas, que constituíram a maioria dos casos neste estudo (57,69%). Outro possível fator diz respeito a maior vigilância e notificação de casos de infecção por VZK no Brasil desde 2015, devido à descrição da SCZ neste ano.
Todas as 26 crianças do estudo apresentaram alguma anormalidade clínica. Dezenove das 26 crianças (73,08%) apresentaram microcefalia. Em contexto semelhante, Ventura et al. também mostraram uma alta prevalência de microcefalia em sua amostra de 60 crianças, chegando a 85% da amostra28. Essa alta prevalência pode refletir um viés de seleção devido aos hospitais onde ocorreram os dois estudos serem referência para SCZ na época. Também foram muito comuns as outras alterações sistêmicas em nosso estudo, como disfunção motora e cognitiva e outros distúrbios neurológicos. A alta prevalência de todas essas alterações esteve diretamente relacionada ao estágio provável em que ocorreu a infecção por VZK durante a gravidez. Quatorze das mães dos 26 pacientes neste estudo relataram sintomas semelhantes aos da dengue durante o 1º ou 2º trimestre de gravidez, levando a uma alta prevalência de alterações oftalmológicas nessas crianças.
A maioria dos olhos das crianças (37/52 ou 71,15%) apresentou alguma anormalidade. Anomalias de fundo de olho foram encontradas em 44,23% dos olhos examinados e em 55,26% dos olhos de pacientes com microcefalia. A prevalência de alterações oculares foi maior neste estudo em comparação com o estudo de Freitas et al.1, que encontraram anormalidades oculares em 34,5% (10/29) das crianças com microcefalia. Contudo, esse estudo menciona apenas alterações do fundo de olho e não relata pesquisas sobre outras alterações oculares comuns na SCZ, como erros de refração, alinhamento ocular e nistagmo. Um estudo de Verçosa et al.30 mostrou que 25 de 70 crianças (36%) com diagnóstico presumível de microcefalia por SCZ apresentaram alterações oculares. Essas alterações compreendem alterações de fundo de olho, estrabismo e nistagmo, mas, novamente, não são mencionados erros de refração. Ambos os estudos relacionam a microcefalia com uma maior incidência de alterações oculares. Portanto, as alterações neurológicas têm relação direta com a presença de alterações oftálmicas, potencialmente tendo uma infecção viral mais precoce no período gestacional como denominador comum. Com base nisso, esperava-se que, neste estudo, fossem encontradas anormalidades do fundo de olho em uma proporção maior de crianças que tiveram infecção por VZK durante o 1º ou 2º trimestre gestacional. Entretanto, essa proporção foi de apenas 50% (7/14). Isso pode ser explicado pela imprecisão e subjetividade que ocorreu na determinação da idade gestacional em que ocorreu a infecção. Um grande número de mães não perceberam a presença de sintomas ou não apresentaram sintomas de infecção por VZK (pacientes assintomáticas) mas podem ter sido infectadas por VZK durante os dois primeiros trimestres. Além disso, a maioria dessas mães não realizou testes sorológicos e/ou moleculares confirmatórios.
As prevalências de nistagmo e estrabismo foram altas (19,23% e 53,85% respectivamente). Verçosa et al.30 descreveram uma prevalência de 8,57% de nistagmo e 14,29% de estrabismo. Outros autores reportaram prevalências ainda maior de estrabismo: 60% em um estudo17 e 92%28 em outro. Esses achados foram bastante comuns na SCZ, tendo como resultado alterações estruturais na retina e no nervo óptico e anormalidades neurológicas.
As anormalidades da motilidade ocular intrínseca têm sido raramente descritas na literatura28. Ventura e al. encontraram um defeito no reflexo fotomotor direto em apenas uma criança na amostra de 60 crianças (2%)30. No presente estudo, quatro crianças apresentaram diminuição dos reflexos consensual e fotomotor direto; duas delas apresentaram midríase média e uma apresentou anisocoria durante a avaliação. As anormalidades do nervo óptico, neurológicas centrais ou devido à lesão da musculatura da íris19 pelo vírus Zika justificam a alteração desses reflexos.
Achados do segmento anterior (ceratopatia puntiforme em uma criança e blefarite em outra) não têm relação causal conhecida com infecções congênitas por VZK.
O EE médio de AO encontrado neste estudo (+0,49 D) é considerado normal, semelhante ao de outros estudos com amostras com crianças saudáveis22. Entretanto, uma análise caso a caso mostra que a prevalência de erros refrativos (24 em 52 olhos ou 46,15%) em pacientes com SCZ é maior do que na população da mesma faixa etária. Ventura et al.17, em seu relato de uma série de casos, encontraram alta prevalência de miopia (40%), sendo anormal para a faixa etária estudada. Em outro estudo28, a taxa de erros refrativos significativos, com necessidade de óculos, foi de 43,7%. Esses achados sugerem que os erros refrativos são comuns em crianças com SCZ e que elas devem receber periodicamente avaliação refrativa como rotina.
Em nossa amostra, foi possível inferir uma relação entre erros refrativos e alterações de fundo de olho. Dos 29 olhos com EE normal, dezessete tinham fundoscopia normal, enquanto que dos 23 olhos com algum tipo de ametropia apenas cinco tinham fundo de olho normal. Da mesma forma, pacientes com distúrbios neurológicos apresentam maior incidência de erros refrativos28,29. É crucial, novamente, que crianças com SCZ, principalmente aquelas com alterações neurológicas e fundoscópicas, recebam atenção especial na busca de erros refrativos.
O glaucoma é raramente descrito como um dos componentes da CZS. Neste estudo, embora algumas crianças tivessem escavação aumentada do disco óptico, nenhuma tinha PIO elevada. A ECC parece ser uma variável independente no desenvolvimento do glaucoma31,32. A ECC infantil tende a ser ligeiramente maior nos primeiros dois a quatro anos de idade quando comparado aos adultos3. A ECC média das crianças no presente estudo foi 568,33 ±46,21μm (482,00-710,00μm) para AO. Valores semelhantes de ECC foram encontrados no estudo de Gul et al.4 em uma amostra de crianças saudáveis com idade entre um e dois anos (556 µm). Além disso, o aumento da escavação papilar isoladamente, mesmo com maior ECC, sem associação com outros dados alterados na investigação de glaucoma, como DPA e diâmetro corneano, que eram normais nessas crianças, é insuficiente para a confirmação diagnóstica do glaucoma. Portanto, nenhum de nossos pacientes teve diagnóstico confirmado de glaucoma.
Saw et al. concluíram que crianças com maior DPA apresentavam maior peso, ou maior comprimento corporal ou maior circunferência craniana ao nascer27. Neste estudo, embora o DPA médio de crianças com microcefalia tenha sido semelhante ao da amostra total (20,91 ± 1,21 mm [18,36-24,19 mm] x 21,08 ± 1,21 mm [18,36-24,19 mm]), o DPA médio de crianças sem microcefalia foi superior (21,55 ± 1,13 mm [20,05-23,79 mm]). Há uma tendência, portanto, para que crianças microcefálicas tenham olhos com DPAs menores, dentro da faixa etária examinada. Entretanto, todas essas médias são consideradas normais, sendo semelhantes às de outros estudos com crianças sem alterações oftalmológicas ou sistêmicas16,24.
Embora a fisiopatologia ocular exata das infecções pré-natais e adquiridas não seja conhecida, acredita-se que o VZK tenha tropismo pelo segmento posterior do olho, especialmente pela mácula. Existem vários relatos de cicatrizes coriorretinianas e alterações congênitas do EPR, sugerindo uma alteração inicial na retina externa1,28. Mais recentemente, casos de uveíte posterior ativa em adultos causados por VZK foram descritos, indicando envolvimento inflamatório inicial na retina externa e/ou na coroide25,26.
Os arbovírus têm um grande potencial para se tornarem epidêmicos. O surto de infecção pelo VZK ocorrido no Brasil, em 2015, revelou essa grande capacidade de disseminação do vírus para diversas regiões onde o A. aegypti é endêmico. A infecção por VZK tem atraído grande atenção por parte da comunidade científica e dos profissionais de saúde devido aos seus efeitos teratogênicos devastadores. As alterações oftalmológicas e sistêmicas encontradas na SCZ se manifestam ao longo da vida da criança. Desta forma, é fundamental a divulgação de informações para o controle dessa temida síndrome. O conhecimento dos métodos de controle dos mosquitos, das medidas de prevenção do contágio do VZK, e das malformações congênitas relacionadas à infecção, além do diagnóstico e tratamento precoce dessas anormalidades e ainda de programas de reabilitação cognitiva e física são essenciais para que o impacto pessoal e social nas crianças com SCZ seja reduzido.
As limitações do estudo incluem o tamanho da amostra utilizada e o encaminhamento de crianças já diagnosticadas ou com suspeita de infecção congênita pelo VZK. Mais estudos33 com um número maior de crianças são necessários para confirmar os dados observados neste estudo.
REFERÊNCIAS
1. Freitas BP, Dias JRO, Prazeres J, Sacramento GA, Ko AI, Maia M, et al. Ocular Findings in Infants With Microcephaly Associated With Presumed Zika Virus Congenital Infection in Salvador, Brazil. JAMA Ophthalmol. 2016;134(5):529-35.
2. Dick GW, Kitchen SF, Haddow AJ. Zika virus, I: Isolations and serological specificity. Trans R Soc Trop Med Hyg. 1952;46:509-20.
3. Besnard M, Lastère S, Teissier A, Cao-lormeau V, Musso D. Evidence of perinatal transmission of Zika virus, French Polynesia, December 2013 and February 2014. Euro Surveill. 2014,19(13):20751.
4. Center for Disease Control and Prevention (CDC). Transmission and risks.[recurso eletrônico]. Acessado em janeiro/2021. Disponível:, <http://cdc.gov/zika/transmission/index.html>
5. Foy BD, Kobylinski KC, Foy JLC, Blitvich BJ, Rosa AT, Haddow AD, et al. Probable non-vector-borne transmission of Zika virus, Colorado, USA. Emerg Infect Dis. 2011;17(5):880-2.
6. Faye O, Freire CC, Iamarino A, Faye O, Oliveira JVC, Diallo M, et al. Molecular evolution of Zika virus during its emergence in the 20(th) century. PLoS Negl Trop Dis. 2014;8(1):e2636.
7. Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, et al. Zika virus outbreak on Yap Island, Federated States of Micronesia. N Engl J Med. 2009;360(24):2536-43.
8. Cao-Lormeau VM, Roche C, Teissier A, Robin E, Berry AL, Mallet HP, et al. Zika virus, French Polynesia, South Pacific. 2013. Emerg Infect Dis. 2014;20(6):1085-6.
9. Roth A, Mercier A, Lepers C, Hoy D, Duituturaga S, Benyon E, et al. Concurrent outbreaks of dengue, chikungunya and Zika virus infections - an unprecedent epidemic wave os mosquito-borne viruses in the Pacific 2012-2014. Euro Surveill. 2014;19(41):20929.
10. Musso D, Nilles EJ, Cao-Lormeau VM. Rapid spread of emerging Zika virus in the Pacific area. Clin Microbiol Infect. 2014; 20(10):O595-6.
11. Campos GS, Bandeira AC, Sardi SI. Zika virus outbreak Bahia, Brazil. Emerg Infect Dis. 2015;21(10):1885-6.
12. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Monitoramento dos casos de microcefalia no Brasil até a Semana Epidemiológica 47. Informe Epidemiológico - Semana Epidemiológica 47. 2015.
13. Brasil. Ministério da Saúde. Secretaria de Atenção à Saúde. Protocolo de atenção à saúde e resposta à ocorrência de microcefalia relacionada à infecção pelo vírus zika. Acessado em Janeiro/2021, disponível em <https://bvsms.saude.gov.br/bvs/publicacoes/protocolo_resposta_microcefalia_relacionada_infeccao_virus_zika.pdf>
14. Moore CA, Staples JE, Dobyns WB, Pessoa A, Ventura CV, Fonseca EB, et al. Characterizing the pattern of anomalies in congenital Zika syndrome for pediatric clinicians. JAMA Pediatr. 2017;171(3):288-95.
15. Tang H, Hammack C, Ogden SC, w z, Qian X, Li Y, et al. Zika virus infects human cortical neural progenitors and attenuates their growth. Cell Stem Cell. 2016;18(5):587-90.
16. Isenberg SJ. Physical and refractive characteristics of the eye at birth and during infancy. In: Isenberg SJ, editor. The eye in infancy. 2nd edition. St. Louis: Mosby; 1994; p.36-51.
17. Ventura CV, Maia M, Ventura BV, Linden VVD, Araújo EB, Ramos RC, et al. Ophthalmological findings in infants with microcephaly and presumable intra-uterus Zika virus infection. Arq Bras Oftalmol. 2016;79(1):1-3
18. Singh PK, Guest JM, Kanwar M, et al. Zika virus infects cells lining the blood-retinal barrier and causes chorioretinal atrophy in mouse eyes. JCI Insight. 2017;2(4):e92340.
19. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Secretaria de Atenção à Saúde. Orientações integradas de vigilância e atenção à saúde no âmbito da Emergência de Saúde Pública de Importância Nacional: procedimentos para o monitoramento das alterações no crescimento e desenvolvimento a partir da gestação até a primeira infância, relacionadas à infecção pelo vírus Zika e outras etiologias infeciosas dentro da capacidade operacional do SUS. Acessado em Janeiro/2022. Disponível em: <https://bvsms.saude.gov.br/bvs/publicacoes/orientacoes_integradas_vigilancia_atencao_emergencia_saude_publica.pdf>
20. Fernandez MP, Saad EP, Martinez MO, Corchuelo S, Reyes MM, Herrera MJ, et al. Ocular Histopathologic Features of Congenital Zika Syndrome. JAMA Ophthalmol. 2017;135(11):1163-9.
21. Honein MA, et al. Birth defects among fetuses and infants of US women with evidence of possible Zika virus infection during pregnancy. JAMA. 2017;317(1):59-68.
22. World Health Organization (WHO). Screening, assessment and management of neonates and infants with complications associated with Zika virus exposure in utero. Acessado em Janeiro/2022. Disponível em: <http://apps.who.int/iris/bitstream/10665/204475/1/WHO_ ZIKV_MOC_16.3_eng.pdf>.
23. Mayer DL, Hansen RM, Moore BD, Kim S, Fulton AB. Cycloplegic refractions in healthy children aged 1 through 48 months. Arch Ophthalmol. 2001 Nov;119(11):1625-8.
24. Gul A, Caglar C, Cinal A, Yasar T, Kilic A. Ocular biometry and central corneal thickness in children: a hospital-based study. Arq Bras Oftalmol. 2014;77(3):152-4
25. Parke III DW, Almeida DR, Albini TA, Ventura CV, Berrocal AM, Mittra RA. Serologically confirmed zika-related unilateral acute maculopathy in an adult. Ophthalmology. 2016;123(11):2432-3.
26. Kodati S, Palmore TN, Spellman FA, Cunningham D, Weistrop B, Sen HN. Bilateral posterior uveitis associated with Zika virus infection. Lancet. 2017;389(10064):125-26.
27. Saw SM, Tong L, Chia KS, Koh D, Lee YS, Katz J, et al. The relation between birth size and the results of refractive error and biometry measurements in children. Br J Ophthalmol. 2004;88(4):538-42.
28. Ventura LO, Lawrence L, Ventura CV, Dutton GN, Marinho P, Ferro PF, et al. Response to correction of refractive errors and hypoaccommodation in children with congenital Zika syndrome. J AAPOS. 2017;21(6):480-4.
29. McClelland JF, Parkes J, Hill N, Jackson AJ, Saunders KJ. Accommodative dysfunction in children with cerebral palsy: a population-based study. Invest Ophthalmol Vis Sci. 2006;47(5):1824-30.
30. Verçosa I, Carneiro P, Verçosa R, Girão R, Ribeiro EM, Pessoa A, et al. The visual system in infants with microcephaly related to presumed congenital Zika syndrome. J AAPOS. 2017;21(4):300-304.
31. Amini H, Fakhraie G, Abolmaali S, Amini N, Daneshvar R. Central Corneal Thickness in Iranian Congenital Glaucoma Patients. Middle East Afr J Ophthalmol. 2012;19(2):194-8.
32. Gordon MO, Beiser JA, Kass MA. The ocular hypertension treatment study: baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):714-20; discussion 829-3.
33. Ferreira CCM, Tavares IM. Intraocular pressure and central corneal thickness in full-term newborns. Arq Bras Oftalmol. 2017;80(5):313-6.



Financiamento: Declaram não haver.
Conflitos de Interesse: Declaram não haver.
Recebido em:
21 de Julho de 2022.
Aceito em:
17 de Dezembro de 2022.