Carlos A. Moreira Jr1,2; Carlos A. Moreira Neto2,3; Jacó Lavinski4
DOI: 10.17545/eOftalmo/2023.0008
RESUMO
Os autores fazem uma revisão sobre coroidopatia central serosa, mostrando detalhes de sua fisiopatologia, apresentação clínica e exames de imagem que bem definem a doença. Comentam ainda sobre os diversos tipos de tratamento, dando ênfase à terapia fotodinâmica e outros tipos de laser, especificamente o laser de comprimento de onda vermelha.
Palavras-chave: Coroidoretinopatia; Estresse; Corticoide; Laser; Terapia fotodinamica.
ABSTRACT
The authors have provided a review of central serous choroidopathy (CSC), showing details of its pathophysiology, clinical presentation, and imaging exams that well define the disease. They have also commented on the various types of treatment, emphasizing photodynamic therapy and other types of laser, specifically the red wavelength laser.
Keywords: Coroidoretinopathy; Stress; Corticoid, Laser; Photodynamic therapy.
INTRODUÇÃO
A vida moderna tem trazido novos desafios e, muitas vezes, com mais ansiedade e tensão emocional. Por isso, doenças que tem fundo emocional, como a coriorretinopatia serosa central (CSC), tem se tornado cada vez mais frequentes. Desta maneira, é importante que os oftalmologistas, retinólogos e oftalmologistas gerais, tenham um bom conhecimento acerca da CSC.
Diversas denominações já foram utilizadas para essa patologia, como retinopatia serosa central, mas atualmente é chamada de coriorretinopatia serosa central (CSC) devido ao envolvimento comprovado da coroide e da retina.
A doença caracteriza-se pela presença de um ou mais pontos de extravasamento de contraste ao nível do epitélio pigmentado da retina (EPR), levando ao acúmulo de líquido no polo posterior e resultando em descolamento seroso da retina.
Existem duas formas da doença: a aguda, na qual há resolução espontânea em algumas semanas, e a crônica, na qual episódios recorrentes e/ou persistentes de extravasamento levam a atrofia do EPR e baixa visual permanente.
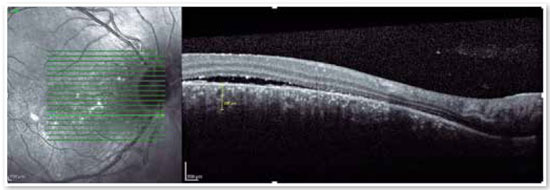
Apesar de a fisiopatogenia não ser bem esclarecida, possivelmente ocorre desregulação da microcirculação coriocapilar, levando ao extravasamento de fluido para o espaço logo abaixo do EPR, lesando e reduzindo a atividade dessas células. O acúmulo de líquido eventualmente é capaz de atravessar o EPR e atingir o espaço sub-retiniano (Figura 1). Normalmente ocorre a reabsorção espontânea do líquido. Entretanto, se a desregulação microvascular permanecer, o processo será perpetuado, resultando em recorrências1.
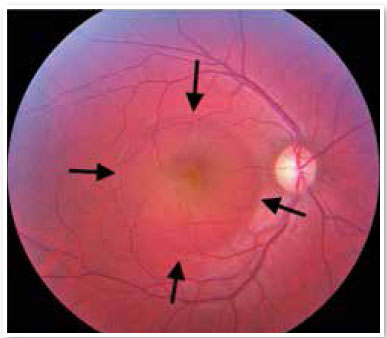
A angiografia fluoresceínica é capaz de evidenciar esses focos de extravasamento (únicos ou múltiplos) que levam ao descolamento do EPR e/ou da retina neurossensorial, caracterizando a CSC (Figura 2)
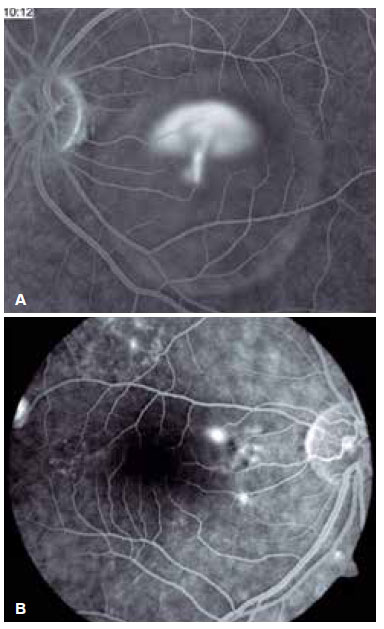
A indocianina verde é capaz de demonstrar múltiplas áreas de aumento da permeabilidade vascular da coroide. Esse aumento de permeabilidade poderia elevar a pressão hidrostática tecidual, levando a um dano importante ao EPR, permitindo, consequentemente, a passagem de fluido para o espaço sub-retiniano2.
Os níveis séricos aumentados de corticosteroides e catecolaminas também estão relacionados à CSC3. Episódios de estresse, personalidades do tipo A, doença de Cushing, período gestacional e até mesmo o uso crônico de corticosteroides estão envolvidos na patogênese, apesar de o mecanismo não ser ainda bem definido. Acredita-se que possam influenciar a regulação do fluxo sanguíneo na coroide, por vasoconstrição, por influência na regulação do óxido nítrico e pelo aumento da permeabilidade ou da fragilidade dos capilares4.
Inicialmente, acreditava-se que houvesse uma incidência muito maior de casos em homens entre 30 e 50 anos. Entretanto, em 1996, Spaide et al. concluíram, em um estudo com 130 pacientes, que a relação era de apenas 2,6:1, e mais da metade tinha idade acima de 50 anos5, Brancos, hispânicos e asiáticos estão entre as raças mais acometidas, sendo menos frequente em negros6.
SINTOMAS E ACHADOS CLÍNICOS
A maioria dos sintomas inclui alterações visuais variando entre 20/20 e 20/200, sendo que alguns pacientes podem apresentar somente alterações na tabela de Amsler. Entre as manifestações mais frequentes, encontramos queixas como metamorfopsia, micropsia, discromatopsia, escotoma central, redução da sensibilidade ao contraste, ou até hipermetropização, principalmente devido ao deslocamento anterior da retina.
Ao exame biomicroscópico do fundo de olho, encontramos elevação da retina neurossensorial no polo posterior de tamanho variável. Ocorre a perda do reflexo foveal, que eventualmente assume uma coloração amarelada, decorrente da xantofila retiniana, que se torna mais visível.
Adjacente ao descolamento da retina neurossensorial, o EPR também se encontra descolado, normalmente numa posição superior. Com o advento da tomografia de coerência óptica (optical coherence tomography, OCT), foi possível identificar uma incidência maior de descolamentos do EPR, além de caracterizar bem seus formatos. Através de estudos histopatológicos, também foi identificada a presença de fibrina sub-retiniana e sub-EPR, assim como de lipídios sub-retinianos, principalmente em casos recorrentes ou crônicos7.
Alguns casos podem apresentar um descolamento periférico da retina neurossensorial, em que um extravasamento intenso ou prolongado no polo posterior pode levar ao acúmulo inferior do líquido. Esses casos normalmente apresentam uma espécie de ligação entre a área de origem e a área de acúmulo, muitas vezes rasa. Esse “canal” acaba sendo identificado como uma área de EPR atrófico, telangiectasias, isquemia da retina distal e, até mesmo, depósitos perivasculares ou espículas ósseas (pseudorretinite pigmentosa). Casos crônicos também podem evoluir com cistos retinianos, edema macular cistoide e até membrana neovascular sub-retiniana8.
ASSOCIAÇÃO COM DOENÇAS SISTÊMICAS
Apesar de ser considerada uma doença idiopática, algumas associações sistêmicas têm sido observadas, principalmente nos casos crônicos ou recorrentes. Situações como gestação, doença renal terminal, lúpus eritematoso sistêmico (LES)9, pacientes transplantados10, disfunções da produção de corticoides endógenos11, uso de anfetaminas12, uso de corticoides sistêmicos, epidurais e até mesmo inalatórios são alguns exemplos de associações descritas com a CSC.
Doenças que possam levar à isquemia coriocapilar por vasoespasmo ou por precipitações de imunocomplexos, como LES, poliarterite nodosa, síndrome de Goodpasture, granulomatose de Wegener, hipertensão acelerada, toxemia gravídica, coagulação intravascular disseminada e púrpura trombocitopênica idiopática13, também podem lesar o EPR, levando ao descolamento deste e da retina neurossensorial.
Alguns autores têm descrito associações entre CSC e refluxo gastroesofágico, em uma possível relação com Helicobacter pylori, ainda a ser devidamente esclarecida14. Também tem sido descrita a associação com apneia obstrutiva do sono15.
TÉCNICAS DE IMAGEM
Angiografia fluoresceínica
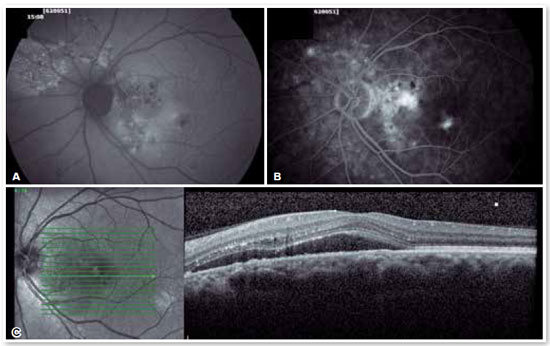
O padrão clássico do exame apresenta um ou mais pontos de extravasamento de contraste no polo posterior, em nível do EPR, preenchendo lentamente o descolamento seroso sem ultrapassar os seus bordos no decorrer do exame. Aproximadamente 10% dos casos apresentam um padrão de “fumaça de chaminé”, em que o extravasamento se difunde superior e lateralmente, assumindo um aspecto de “guarda-chuva” ou “cogumelo” nos limites superiores do descolamento (Figura 2A). Em apenas 10% dos casos, o extravasamento ocorre na fóvea. Entretanto, a maioria concentra-se na área a 1 mm da fóvea, tornando-se raros além dessa distância. Quando não visualizado, o local muito provavelmente encontra-se no limite superior do descolamento, ou já está cicatrizado.
Indocianina verde
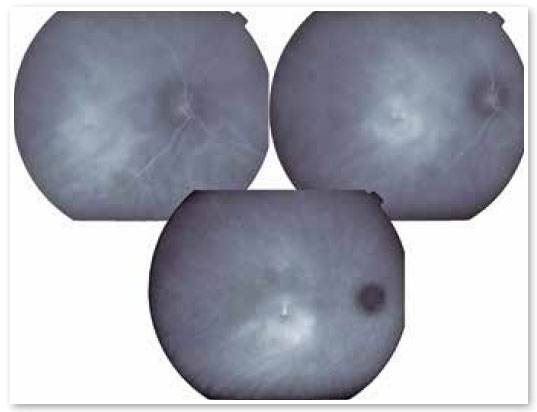
A presença de hiperpermeabilidade das porções mais internas da coroide é o achado mais frequente do exame, mais bem visualizado nas fases intermediárias. Nas fases mais tardias, ocorre a difusão do contraste centrifugamente a partir do foco inicial. Os focos de hiperpermeabilidade ocorrem também em áreas aparentemente normais e não correspondentes aos pontos de extravasamento identificados na angiografia fluoresceínica. Foram identificadas também áreas de ingurgitamento venoso e fluxo lentificado que, embora inespecíficas, contribuem para que alguns autores sugiram que a CSC possa ser uma patologia menos localizada do que se imaginava (Figura 3).
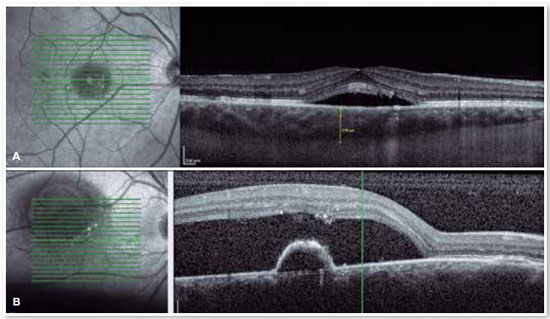
Tomografia de coerência óptica
O advento da OCT trouxe uma maneira mais objetiva de quantificar o tamanho dos descolamentos, tanto de EPR quanto de retina neurossensorial, permitindo um acompanhamento mais preciso do curso clínico da doença. Além de avaliar com precisão o local e a quantidade de fluido sub-retiniano e o local e tamanho do descolamento do epitélio pigmentar, a OCT avalia a espessura da coroide (Figura 4A e B), frequentemente alterada na CSC, a tal ponto de ser considerada uma doença no espectro da paquicoroide16.
HISTÓRIA NATURAL DA DOENÇA
Aproximadamente 3 meses após o início dos sintomas, o descolamento seroso é reabsorvido espontaneamente, deixando apenas uma cicatriz no EPR, normalmente maior do que o ponto de extravasamento. O paciente recupera a visão prévia na grande maioria das vezes (mais de 90%). Apenas 5% dos casos evoluem com perda visual grave e permanente17.
Em torno de 30 a 50% dos pacientes desenvolverão novos episódios, 10% terão três ou mais recorrências, e 40% podem apresentar CSC no olho contralateral18,19. Em 50%, a recorrência ocorre no primeiro ano, enquanto no restante em até 10 anos ou mais. Alguns desenvolvem descolamentos crônicos envolvendo a área macular, membrana neovascular sub-retiniana, atrofia de EPR ou degenerações císticas maculares com perda importante da acuidade visual. Fatores de mau prognóstico incluem: grandes descolamentos do EPR, recorrências, depósitos de fibrina, múltiplos pontos de extravasamento e “canais” de atrofia do EPR.
DIAGNÓSTICO DIFERENCIAL
Qualquer patologia que leve ao descolamento seroso da retina neurossensorial deve ser incluída no diagnóstico diferencial de CSC, principalmente as que envolvem o polo posterior.
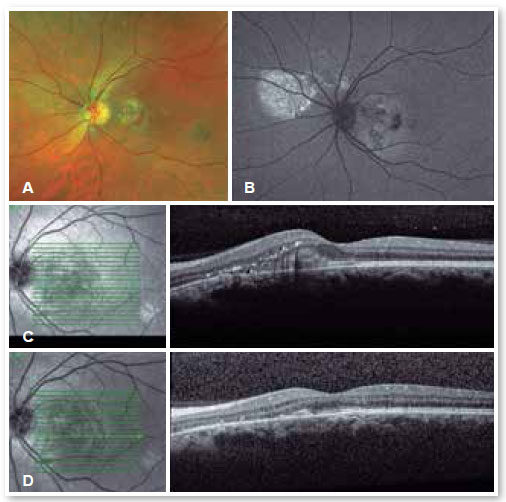
Doenças inflamatórias, como síndrome da histoplasmose presumida, doença de Harada, esclerite posterior, oftalmia simpática e síndrome de efusão uveal, devem ser consideradas, assim como tumores, incluindo melanoma, osteoma, hemangioma (Figura 5), metástase de coroide, além de infiltrados leucêmicos.
Doenças do colágeno, incluindo LES, poliarterite nodosa, esclerodermia, dermatomiosite e policondrite recidivante, podem causar necrose fibrinoide dos vasos da coroide, enquanto hipertensão maligna, toxemia gravídica e coagulação intravascular disseminada, por oclusão da coriocapilar, podem também levar ao descolamento seroso.
Casos de fosseta de nervo óptico podem iniciar com um descolamento seroso macular, e a angiografia pode auxiliar, pois não apresenta ponto de extravasamento. A OCT confirma o diagnóstico facilmente.
Em pacientes com mais de 50 anos, principalmente nos casos crônicos de CSC, em que ocorrem várias alterações do EPR e, eventualmente, o desenvolvimento de membrana neovascular sub-retiniana, deve-se fazer o diagnóstico diferencial com degeneração macular relacionada à idade (DMRI). A indocianina verde torna-se útil, na medida em que demonstra hiperfluorescência múltipla precoce que desaparece com o tempo, enquanto, na DMRI, apresenta hiperfluorescência que permanece até as fases mais tardias. Atualmente, o exame de OCT e angiografia por OCT confirmam o diagnóstico de membrana neovascular de forma cabal.
A angiografia fluoresceínica e a indocianina verde auxiliam no diagnóstico da vasculopatia polipoidal da coroide, identificando claramente a alteração vascular. A OCT também pode fornecer pistas diagnósticas muito consistentes, como o amplo descolamento de epitélio pigmentar ou o descolamento de EPR em dupla corcova.
TRATAMENTO
Considerando a resolução espontânea na grande maioria dos casos, recomenda-se apenas a observação clínica nos 3 primeiros meses de evolução, naqueles pacientes que não tenham impedimento de sua atividade laboral pela alteração visual. Deve-se recomendar a redução do uso de quaisquer corticosteroides tópicos, orais e nasais, entre outros.
Ainda, pacientes com personalidade tipo A, em geral muito estressados, devem ser aconselhados a mudar o estilo de vida, a fazer exercícios físicos regularmente e até mesmo a procurar ajuda psicológica.
TRATAMENTO CLÍNICO
Para casos rebeldes, em que não há resolução espontânea ou que se tornam crônicos, é possível a utilização de medicações que inibem a produção de mineralocorticoides, os anticorticosteroides, como a espironolactona20,21 e a finasterida22, entre outros. Moduladores do sono como a melatonina, betabloqueadores para diminuir o nível de estresse, aspirina e até rifampicina já foram usados e têm resultados controversos. Injeções intravítreas de anti-fator de crescimento endotelial vascular (vascular endothelial growth factor, VEGF) não provaram ser eficazes no tratamento da CSC23, porém devem ser usadas nos casos de complicações, como o aparecimento de membrana neovascular sub-retiniana (Figuras 6 e 7) ou de vasculopatia polipoidal de coroide.
TRATAMENTO COM LASER TÉRMICO
Considera-se o tratamento com a aplicação de fotocoagulação somente nos casos em que o ponto de extravasamento for distante da fóvea, quando o paciente tiver apresentado CSC no olho contralateral com evolução ruim ou recorrência no olho que teve perda visual importante em episódio prévio. Em casos crônicos, com grandes descolamentos serosos inferiores ou alterações difusas do EPR, também devemos considerar tratamento.
Após a aplicação do laser, casos simples levam 2 semanas para reabsorver o líquido sub-retiniano, enquanto os casos mais complicados podem levar até 6 semanas.
Possíveis complicações da aplicação do laser próximo à área foveal, como escotoma persistente, membrana neovascular secundária e aumento progressivo da cicatriz do EPR, devem sempre ser discutidas com o paciente antes da aplicação.
A técnica de fotocoagulação utilizada deve utilizar parâmetros como disparos de curta duração, pequeno tamanho de mira e intensidade suficiente apenas para causar uma mancha discreta e leve no EPR.
TRATAMENTO COM LASER VERMELHO DE PULSO CURTO
O laser vermelho de pulso curto tem mostrado ótimos resultados, mesmo em casos com vazamentos muito próximos à fóvea. A justificativa para esse tipo de tratamento está baseada em uma queimadura muito leve, quase invisível, com duração de 10 mseg, que apenas atinge o EPR sem afetar as camadas retinianas suprajacentes, diminuindo assim o risco de escotomas e perda visual. As Figuras 8 e 9 mostram um caso com vazamento crônico justafoveal e que teve excelente resultado com esse tipo de tratamento.
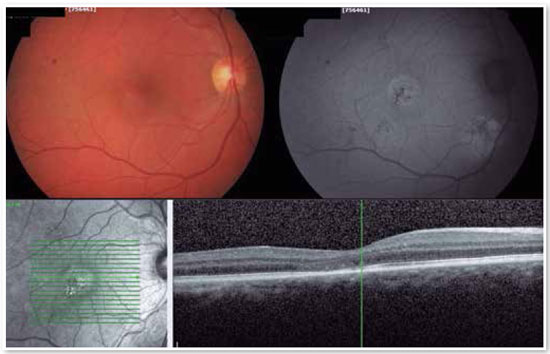
TRATAMENTO COM LASER DE MICROPULSO
O laser de micropulso é uma boa alternativa para tratar CSC com vazamentos na zona avascular da fóvea, pois não causa lesão de fotorreceptores. Esse tipo de laser libera energia em envelopes, diminuindo o aquecimento das estruturas retinianas adjacentes, e faz com que o efeito terapêutico seja apenas sobre o EPR. Múltiplos envelopes de energia liberados sobre o EPR doente promovem restauração da barreira hematorretiniana externa, que por fim leva à absorção do fluido sub-retiniano na CSC. Por outro lado, esse tipo de tratamento não atua sobre a disfunção da coroide e, por isso, nem sempre é efetivo24.
TRATAMENTO COM TERAPIA FOTODINÂMICA
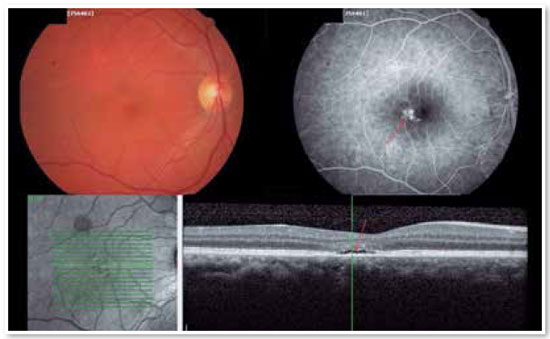
Para os casos de CSC crônica e que estejam colocando a visão central do paciente em risco, a terapia fotodinâmica (photodynamic therapy, PDT) é um excelente tratamento. Utilizada com ótimos resultados há algum tempo, a PDT é a injeção de um contraste intravenoso chamado verteporfina, que se acumula na coroide a ser tratada, absorvendo a luz de um laser não térmico infravermelho (690 nm) que promove a diminuição da circulação coroideana local e atua fortalecendo a barreira hematorretiniana externa (EPR). Com o tratamento, ocorre diminuição da espessura da coroide, diminuição da circulação coroideana e consequente ausência de extravasamento de fluido para o espaço sub-retiniano, curando o problema (Figura 10).
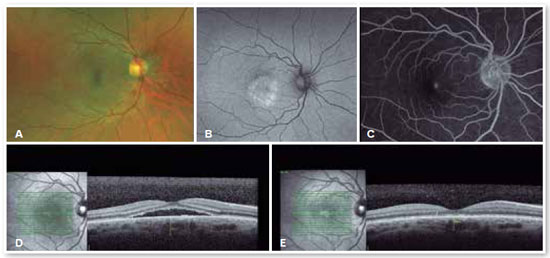
Devido ao risco de isquemia coroideana, o tratamento padrão para o tratamento da CSC é a PDT de meia-fluência (metade da potência no laser) ou meia-dose de verteporfina25. Não existe estudo definindo qual a melhor alternativa, mas, por experiência pessoal, acreditamos que a meia-fluência é mais efetiva.
REFERÊNCIAS
1. Klais CM, Ober MD, Ciardella AP et al. Central serous chorioretinopathy. In: Ryan SJ, editor. Retina, vol. 2. Filadélfia: Elsevier; 2006. p. 1137-9.
2. Guyer DR, Yannuzzi LA, Slakter JS, Sorenson JA, Ho A, Orlock D. Digital indocyanine green videoangiography of central serous chorioretinopathy. Arch Ophthalmol. 1994;112(8):1057-62.
3. Tittl MK, Spaide RF, Wong D, Pilotto E, Yannuzzi LA, Fisher YL, et al. Systemic findings associated with central serous chorioretinopathy. Am J Ophthalmol. 1999;128(1):63-8.
4. Warren JB, Loi RK, Coughlan ML. Involvement of nitric oxide synthase in the delayed vasodilator response to ultraviolet light irradiation of rat skin in vivo. Br J Pharmacol. 1993;109(3):802-6.
5. Spaide RF, Hall L, Haas A, Campeas L, Yannuzzi LA, Fisher YL, et al. Indocyanine green videoangiography of older patients with central serous chorioretinopathy. Retina. 1996;16(3):203-13.
6. Spaide RF, Campeas L, Haas A, Yannuzzi LA, Fisher YL, Guyer DR, et al. Central serous chorioretinopathy in younger and older adults. Ophthalmology. 1996;103(12):2070-9; discussion 2079-80.
7. Yannuzzi LA, Shakin JL, Fisher YL, Altomonte MA. Peripheral retinal detachments and retinal pigment epithelial atrophic tracts secondary to central serous pigment epitheliopathy. Ophthalmology. 1984;91(12):1554-72.
8. Schatz H, Osterloh MD, McDonald HR, Johnson RN. Development of retinal vascular leakage and cystoid macular oedema secondary to central serous chorioretinopathy. Br J Ophthalmol. 1993;77(11):744-6.
9. Eckstein MB, Spalton DJ, Holder G. Visual loss from central serous retinopathy in systemic lupus erythematosus. Br J Ophthalmol. 1993;77(9):607-9.
10. Fawzi AA, Holland GN, Kreiger AE, Heckenlively JR, Arroyo JG, Cunningham Jr ET. Central serous chorioretinopathy after solid organ transplantation. Ophthalmology. 2006;113(5):805-13.e5.
11. Haimovici R, Rumelt S, Melby J. Endocrine abnormalities in patients with central serous chorioretinopathy. Ophthalmology. 2003;110(4):698-703.
12. Hassan L, Carvalho C, Yannuzzi LA, Iida T, Negrão S. Central serous chorioretinopathy in a patient using methylenedioxymethamphetamine (MDMA) or “ecstasy”. Retina. 2001;21(5):559-61.
13. Klais CM, Ober MD, Ciardella AP et al. Central serous chorioretinopathy. In: Ryan SJ, Schachat AP, editores. Retina, vol. 2. Filadélfia: Elsevier; 2006. p. 1150-53.
14. Cotticelli L, Borrelli M, D’Alessio AC, Menzione M, Villani A, Piccolo G, et al. Central serous chorioretinopathy and Helicobacter pylori. Eur J Ophthalmol. 2006;16(2):274-8.
15. Wu CY, Riangwiwat T, Rattanawong P, Nesmith BLW, Deobhakta A. Association of obstructive sleep apnea with central serous chorioretinopathy and choroidal thickness: a systematic review and meta-analysis. Retina. 2018;38(9):1642-51.
16. Nicholson B, Noble J, Forooghian F, Meyerle C. Central serous chorioretinopathy: update on pathophysiology and treatment. Surv Ophthalmol. 2013;58(2):103-26.
17. Klein ML, Van Buskirk EM, Friedman E, Gragoudas E, Chandra S. Experience with nontreatment of central serous choroidopathy. Arch Ophthalmol. 1974;91(4):247-50.
18. Donald J, Gass M. Pathogenesis of disciform detachment of the neuroepithelium. I. General concepts and classification. Am J Ophthalmol. 1967;63(3):573-85.
19. Donald J, Gass M. Pathogenesis of disciform detachment of the neuroepithelium. II. Idiopathic central serous choroidopathy. Am J Ophthalmol. 1967;63(3):587-615.
20. Herold TR, Prause K, Wolf A, Mayer WJ, Ulbig MW. Spironolactone in the treatment of central serous chorioretinopathy - a case series. Graefes Arch Clin Exp Ophthalmol. 2014;252(12):1985-91.
21. Isaac DLC, Lando L, Silva HM, Avila MP. A bullous variant of central serous chorioretinopathy treated with oral spironolactone. Arq Bras Oftalmol. 2022:S0004-27492022005004216.
22. Forooghian F, Meleth AD, Cukras C, Chew EY, Wong WT, Meyerle CB. Finasteride for chronic central serous chorioretinopathy. Retina. 2011;31(4):766-71.
23. Chung YR, Seo EJ, Lew HM, Lee KH. Lack of positive effect of intravitreal bevacizumab in central serous chorioretinopathy: meta-analysis and review. Eye (Lond). 2013;27(12):1339-46.
24. Yadav NK, Jayadev C, Mohan A, Vijayan P, Battu R, Dabir S, et al. Subthreshold micropulse yellow laser (577 nm) in chronic central serous chorioretinopathy: safety profile and treatment outcome. Eye (Lond). 2015;29(2):258-64.
25. Reibaldi M, Cardascia N, Longo A, Furino C, Avitabile T, Faro S, et al. Standard-fluence versus low-fluence photodynamic therapy in chronic central serous chorioretinopathy: a nonrandomized clinical trial. Am J Ophthalmol. 2010;149(2):307-15.e2.

Financiamento: Declaram não haver.
Conflitos de Interesse: Declaram não haver.
Recebido em:
29 de Janeiro de 2023.
Aceito em:
2 de Fevereiro de 2023.