Alanderson Passos Fernandes Castro1; Julliana Ferrari Libório Castro2; Wagner Naves1; Camila Azevedo1; Carolina Ramos Mosena de Angeloni1
DOI: 10.17545/eOftalmo/2022.0021
RESUMO
Apesar de o glaucoma ser uma neuropatia óptica bastante prevalente e cursar com o achado característico de escavação do disco óptico aumentada, outras patologias oftalmológicas também podem cursar com quadro semelhante. Dessa forma, o diagnóstico correto e precoce da etiologia da alteração ocular é de extrema importância no tratamento dos pacientes, principalmente em casos de doenças potencialmente progressivas e ameaçadoras à vida, como em neoplasias hipofisárias. O presente artigo busca relatar um caso de equívoco no diagnóstico de glaucoma em paciente com lesão expansiva intracraniana paraquiasmática e realizar uma breve discussão sobre aspectos que auxiliam no diagnóstico diferencial dessas condições.
Palavras-chave: Neoplasias hipofisárias; Glaucoma; Diagnóstico Diferencial.
ABSTRACT
Glaucoma is a prevalent optic neuropathy that is characterized by the presence of increased optic disc cupping; however, other ophthalmologic pathologies may also be indicated by similar complications. Therefore, correct and early diagnosis of the etiology of changes in the eye is extremely important in the treatment of patients, especially in cases of potentially progressive and life-threatening diseases, including pituitary neoplasms. Herein, we report a case of misdiagnosis of glaucoma in a patient with a parachiasmatic intracranial expansive lesion, and briefly discuss some aspects that can help in the differential diagnosis of these conditions.
Keywords: Pituitary neoplasms; Glaucoma; Differential diagnosis.
INTRODUÇÃO
O glaucoma é uma neuropatia óptica degenerativa multifatorial, a qual constitui a segunda maior causa de cegueira no mundo, estima-se 76 milhões de pessoas acometidas por glaucoma no mundo em 2020, com aumento para 111,8 milhões de doentes em 20401. A neuropatia óptica glaucomatosa (NOG) é a causa mais comum de escavação aumentada do disco óptico, caracterizando-se por perda de rima neurorretiniana, escavação profunda, hemorragias no disco óptico, atrofia peripapilar coriorretiniana, diminuição do diâmetro das arteríolas retinianas, perda difusa ou localizada da CFN e alterações típicas de campo visual (CV)2,3. Todavia, em até 20% dos casos, o achado de escavação aumentada pode ser resultante de outras patologias2,3.
Com relação às neuropatias não glaucomatosas que cursam com tal achado, deve-se recordar da neuropatia óptica isquêmica anterior, das neuropatias hereditárias e lesões compressivas4. Sobre esta última, destacam-se os tumores selares que, comprimindo a via visual anterior, cursam com escavação aumentada antes do surgimento de perda visual, bem como escotomas arqueados no exame de CV, o que poderia ser confundido com NOG3,5-7.
Entre os tumores hipofisários, 50-80% são adenomas, tumores neuroendócrinos benignos bastante comuns, correspondentes a 15,5% de todos os tumores do sistema nervoso central (SNC)8,9. Eles podem ser classificados, pelo seu tamanho, em macroadenomas, a partir de 10mm, e microadenomas, quando menores, além de funcionais e não funcionais, baseado na atividade endócrina8-11. A incidência dos adenomas é de 3,4 casos por 100000 habitantes por ano, com pico bimodal entre 25-45 anos e 60-70 anos9. Os não funcionantes representam 33% dos adenomas hipofisários e, dentre aqueles, os macroadenomas são os mais comuns, chegando a representar 75% dos diagnósticos incidentais9,10. É válido citar também outras lesões que podem acometer a região quiasmática, a exemplo do meningioma paraselar, craniofaringioma e aneurisma de carótida interna12.
Prejuízo visual pode ocorrer por aumento crônico da pressão intracraniana, mais especificamente por compressão ou invasão do tumor na via óptica11. Já os defeitos de campo visual - geralmente hemianopsia bitemporal - e baixa visão ocorrem em 9-32% e 4-16%, respectivamente1. Outras manifestações consistem em cefaleia, neuropatia craniana com ou sem oftalmoplegia, ptose e endocrinopatia11.
Referente ao diagnóstico, a ressonância nuclear magnética (RNM) da região selar é o método padrão-ouro para avaliar adenomas hipofisários. A presença de dano visual, como defeito de campo visual, é indicativo de tratamento cirúrgico. Contudo, em 10-20% dos casos o campo visual não melhora após a cirurgia13.
O tratamento de escolha é a ressecção transesfenoidal, que pode ser feita por abordagem endoscópica ou microscópica, já a via transcraniana é indicada em tumores grandes que se extendem para a fossa media e seio cavernoso. O adenoma não funcionante tem recorrência de aproximadamente 20-30%, portanto RNM é feita a cada 3-6 meses após a cirurgia, anualmente por 5 anos e bianualmente por mais 6 anos. Os dois fatores mais significantes para recorrência são a extensão para o seio cavernoso e a presença de adenoma remanescente após a cirurgia. Radioterapia pós-operatória pode ajudar a diminuir as recorrências de 40% para 10%, mas deve-se ponderar os efeitos colaterais, tais como deficiência hormonal hipofisária, evento cerebrovascular, dano ao nervo óptico, tumores cerebrais9. Dentre outras opções, tem-se a supressão medicamentosa e radioterapia8.
Diante disso, visa-se relatar um caso de macroadenoma hipofisário com alteração importante de função visual simulando glaucoma de pressão normal, com posterior discussão sobre o diagnóstico diferencial entre as duas patologias.
RELATO DO CASO
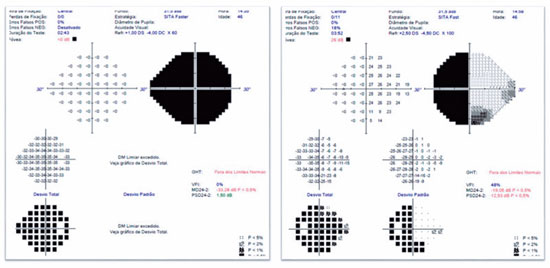
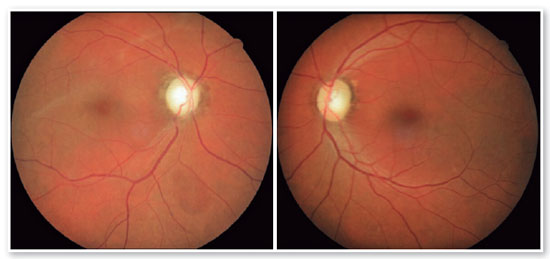
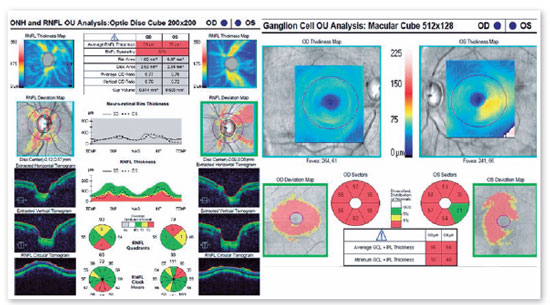
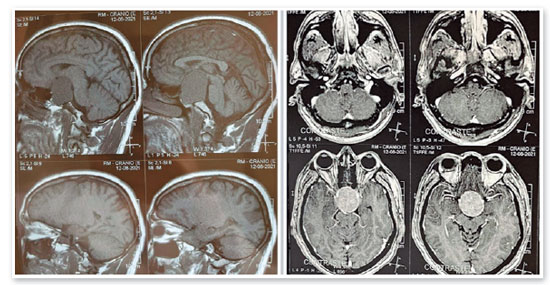
JMCL, 46 anos, queixava-se de perda visual no olho direito (OD) de início há 8 meses. Feito diagnóstico de glaucoma em outro serviço, fez uso de associação de brimonidina 0,2% e timolol 0,5% por 6 meses e iridotomia em ambos os olhos (AO) há 4 meses. Ao exame, apresentava acuidade visual com correção (AVcc) em OD: percepção luminosa (+1,00 -4,00 x 60); Olho esquerdo (OE): 20/50 (+2,50 -4,50 x 100). Reflexo fotomotor direto reduzido em OD, com defeito pupilar aferente relativo, biomicroscopia com iridotomia à 1h em AO, pressão intraocular (PIO) de 12/12 mmHg e fundoscopia com escavação aumentada (0,8 x 0,8) em AO, bem como palidez total de papila e mácula sem alterações em AO. Devido a PIO estar dentro da normalidade e não haver relato sugestivo de crise de glaucoma agudo prévio, levantou-se a hipótese de alteração do disco óptico por causa neurológica ou cardiovascular. Solicitados RNM de crânio, doppler de carótidas, campo visual (CV) 30.2, tomografia de coerência óptica (OCT) e retinografia. Retornou com CV evidenciando amaurose à direita e perda de hemicampo temporal e parte inferior nasal à esquerda (Figura 1); retinografia com atrofia óptica bilateral e sinais de retinopatia hipertensiva grau 1 (Figura 2); OCT do OD com escavação de 0,77 x 0,76 com perda de camada de fibras nervosas (CFN) superior e inferiormente, e OE com escavação de 0,78 x 0,72 com perda de CFN superior e temporal, além de camada de células ganglionares da retina com perdas bilateralmente (Figura 3). Doppler de carótidas com espessamento médio intimal da carótida esquerda, sem placas estenosantes. Por fim, a RNM identificou uma lesão expansiva intracraniana paraquiasmática comprimindo o quiasma óptico (Figura 4), sendo, então, o paciente encaminhado ao serviço de neurocirurgia.
DISCUSSÃO
Apesar de ser a neuropatia óptica mais comumente associada a escavação aumentada do disco óptico, este achado não constitui sinal patognomônico de neuropatia óptica glaucomatosa, fazendo-se necessário o diagnóstico diferencial com outras neuropatias, a exemplo, como no caso relatado, da neuropatia óptica compressiva2,3.
Em muitos casos de neuropatia óptica compressiva (NOC), atrofia do NO é o único achado ao exame fundoscópico, além disso, há uma confusão diagnóstica com o glaucoma de pressão normal (GPN), tendo um estudo observado casuística de 6,5% de pacientes previamente diagnosticados com GPN que possuíam lesão compressiva14.
Um outro estudo de 2011 avaliou 501 pacientes com tumores selares e identificou disco óptico de aparência glaucomatosa significativamente mais frequente do que no grupo controle, estando tal achado mais associado à localização e ao tamanho tumoral, isto é, quanto maior o tumor e mais próximo da abertura interna do canal óptico, mais frequente a aparência glaucomatosa. Entre as hipotéses estudadas, acredita-se que os tumores selares localizados próximos ao NO podem bloquear a passagem de fluido cerebroespinhal para a órbita pelo canal do NO. Com isso haveria um colapso do espaço de fluido cerebrospinhal retrobulbar, ocasionando aumento do gradiente pressórico trans lâmina crivosa. Dessa forma, tal situação mimetizaria o ocorrido em caso de fluido cerebroespinal retrobulbar normal, mas com PIO aumentada. Corroborando tal fato, estudos recentes têm sugerido que alguns pacientes com glaucoma de pressão normal podem ter uma baixa pressão de fluido cerebroespinhal15.
Entretanto, apesar de inicialmente o caso relatado ser similar ao de glaucoma de pressão normal, pacientes glaucomatosos possuem perda da rima neurorretiniana e escavação profunda, enquanto na NOC a rima está preservada, porém mais pálida, o que se percebe ao avaliar a rima mais pálida na retinografia7,14. Reforçando essa afirmativa, um trabalho de 2016 evidenciou que em estágios iniciais, olhos com NOC possuem maior palidez de rima que os com NOG, apesar de um mesmo grau de comprometimento de fibras nervosas, o que refletiria diferentes características histopatológicas em relação à arquitetura da glia em cada patologia. No entanto, em estágios moderados a avançados, tal associação não se manteria14.
Em relação à escavação glaucomatosa, entende-se que ela esteja relacionada à morte de células ganglionares, sendo referida como laminar ou profunda. Acredita-se que a escavação glaucomatosa possua uma maior profundidade laminar anterior em relação à escavação não glaucomatosa5. Baseado nisso, um estudo de 2020 utilizou a medida da largura mínima da rima na abertura da membrana de bruch (BMO-MRW), uma borda anatômica verdadeira da rima neurorretiniana, para avaliação quantitativa da escavação, evidenciando valores significativamente menores nos pacientes com neuropatia óptica glaucomatosa do que nos casos não glaucomatosos5. Quando se compara diretamente NOC e NOG, um outro estudo de 2020 demonstrou que o quociente da BMO-MRW nasal com a CFN peripapilar (N-BMO-MRW/pRNFL) com valores ≥4.24 possuiu sensibilidade e especificidade diagnósticas de 84% e 72%, respectivamente. De outro modo, na neuropatia óptica não glaucomatosa a MRW é preservada, apesar da perda difusa da CFN16. Ainda que de forma isolada essa avaliação não permita o diagnóstico diferencial, contribui-se para considerar outros diagnósticos de etiologia não glaucomatosa e para a realização de exame clínico mais apurado e avaliação da necessidade de exames complementares. Vale ressaltar que essa medida não permite diferenciar especificamente o tipo de neuropatia óptica não glaucomatosa5.
Outro parâmetro utilizado para a diferenciação da NOG e NOC é a espessura da camada de células ganglionares da mácula, principalmente nos subcampos nasais, que cursa com redução de espessura antes do surgimento de alterações de campo visual nos casos de NOC7,17. Outrossim, é bem estabelecido que a NOC acomete mais a CFN temporalmente, principalmente, e nasalmente, enquanto a NOG afeta mais as regiões superior e inferior da CFN3,7,17. Quando comparado a glaucomas iniciais, a perda de fibras do feixe papilomacular é mais comum em neuropatia óptica não glaucomatosa, independentemente da etiologia17. Entretanto, quando há uma comparação com glaucomas avançados essa diferenciação se perde, devido ao comprometimento maior da CFN7.
Por fim, alguns autores citam fatores como indicativos de neuropatia não glaucomatosa e necessidade de investigação neurológica, os quais são: idade jovem (<50 anos), acuidade visual baixa (<20/40), defeitos de campo visual verticais respeitando linha média, palidez de rima neurorretiniana, perda assimétrica da visão de cores e defeito pupilar aferente relativo. Sendo que o paciente do caso relatado possuía ao menos cinco desses fatores, se fazendo ponderar o diagnóstico inicial de glaucoma em favor de etiologia não glaucomatosa4,7.
Apesar de o glaucoma ser uma neuropatia muito mais frequente se comparada às neuropatias ópticas compressivas, deve-se sempre ser realizado um exame clínico detalhado, crítico e atento aos sinais, muitas vezes sutis, de etiologia não glaucomatosa, como os apresentados neste artigo. Dessa forma, poder-se-á oferecer ao paciente um diagnóstico mais apurado de sua real condição, bem como um tratamento adequado, resultando em prognóstico visual mais favorável com a possibilidade de tratamento precoce.
REFERÊNCIAS
1. Allison K, Patel D, Alabi O. Epidemiology of Glaucoma: The Past, Present, and Predictions for the Future. Cureus. 2020;12(11): e11686.
2. Kosior-Jarecka E, Wróbel-Dudzińska D, Pietura R, Pankowska A, Szczuka B, Żarnowska I, et al. Results of Neuroimaging in Patients with Atypical Normal-Tension Glaucoma. Biomed Res Int. 2020 Aug 18;2020:9093206.
3. Lee J, Kim JS, Lee HJ, Kim SJ, Kim YK, Park KH, et al. Discriminating glaucomatous and compressive optic neuropathy on spectral-domain optical coherence tomography with deep learning classifier. Br J Ophthalmol. 2020;104(12):1717-23.
4. Dias DT, Ushida M, Battistella R, Dorairaj S, Prata TS. Neurophthalmological conditions mimicking glaucomatous optic neuropathy: Analysis of the most common causes of misdiagnosis. BMC Ophthalmology. 2017;17(1):2.
5. Leaney JC, Nguyen V, Miranda E, Barnett Y, Ahmad K, Wong S, et al. Bruch’s Membrane Opening Minimum Rim Width Provides Objective Differentiation between Glaucoma and Nonglaucomatous Optic Neuropathies. Am J Ophthalmol. 2020 Oct;218:164-72.
6. Mimouni M, Stiebel-Kalish H, Serov I, Chodick G, Zbedat M, Gaton DD. Optical Coherence Tomography May Help Distinguish Glaucoma from Suprasellar Tumor-Associated Optic Disc. J Ophthalmol. 2019 Oct 29;2019:3564809.
7. Yum HR, Park SH, Park HYL, Shin SY. Macular ganglion cell analysis determined by Cirrus HD optical coherence tomography for early detecting chiasmal compression. PLoS One. 2016;11(4): e0153064.
8. Kim TG, Jin KH, Kang J. Clinical characteristics and ophthalmologic findings of pituitary adenoma in Korean patients. Int Ophthalmol. 2019;39(1):21-31.
9. Mercado M, Melgar V, Salame L, Cuenca D. Clinically non-functioning pituitary adenomas: Pathogenic, diagnostic and therapeutic aspects. Endocrinol Diabetes Nutr. 2017;64(7):384-395.
10. Iglesias P, Arcano K, Triviño V, García-sancho P, Díez JJ, Villabona C, et al. Prevalence, Clinical Features, and Natural History of Incidental Clinically Non-Functioning Pituitary Adenomas. Horm Metab Res. 2017;49(9):654-659.
11. Uche NJ, Uche EO, Eze BI, Amuta DS, Guga DA, Okpara S. Neurophthalmic manifestations of giant sellar tumors in adults: Relationship between endocrine status and visual acuity profile pre and postsurgical treatment: A prospective cohort study. Niger J Clin Pract. 2020;23(11):1500-1506
12. American Academy of Ophthalmology. 2020-2021 Basic and Clinical Science Course, section 05: Neuro-ophthalmology. San Francisco: American Academy of Ophthalmology, 2020.
13. Hisanaga S, Kakeda S, Yamamoto J, Watanabe K, Moriya J, Nagata T, et al. Pituitary Macroadenoma and Visual Impairment: Postoperative Outcome Prediction with Contrast-Enhanced FIESTA. AJNR Am J Neuroradiol. 2017;38(11):2067-2072.
14. Nakano E, Hata M, Oishi A, Miyamoto K, Uji A, Fujimoto M, et al. Quantitative comparison of disc rim color in optic nerve atrophy of compressive optic neuropathy and glaucomatous optic neuropathy. Graefes Arch Clin Exp Ophthalmol. 2016;254(8):1609-16.
15. Qu Y, Wang YX, Xu L, Zhang L, Zhang J, Zhang J, et al. Glaucoma-like optic neuropathy in patients with intracranial tumours. Acta Ophthalmol. 2011;89(5):e428-33.
16. Braga J, Soares R, Loureiro M, Ribeiro L, Meira D. Bruch’s Membrane Opening Minimum Rim Width in the Differential Diagnosis of Optic Neuropathies. Neuroophthalmology. 2019; 44(2):76-88.
17. Xiao H, Liu X, Lian P, Liao LL, Zhong YM. Different damage patterns of retinal nerve fiber layer and ganglion cell-inner plexiform layer between early glaucoma and non-glaucomatous optic neuropathy. Int J Ophthalmol. 2020;13(6):893-901.
INFORMAÇÃO DOS AUTORES



Financiamento: Declaram não haver
Conflitos de Interesse: Declaram não haver
Recebido em:
11 de Julho de 2022.
Aceito em:
11 de Outubro de 2022.