Márcia Beatriz Tartarella1; João Borges Fortes Filho2
DOI: 10.17545/e-oftalmo.cbo/2016.74
RESUMO
Este artigo aborda aspectos atuais sobre a retinopatia da prematuridade (ROP), entidade clínica responsável pela maior quantidade de crianças cegas em todo o mundo nos dias de hoje. Procura chamar a atenção para a importância da triagem na busca da doença em todos os prematuros de muito baixo peso e a necessidade de que a retinopatia seja identificada no momento adequado e tratada pelo laser ao redor da 37ª semana de idade pós-concepção, quando ainda existe chance para o tratamento que deverá ser feito, preferencialmente, durante o tempo de permanência da criança no Centro de Neonatologia. O exame oftalmológico inicial deve ser realizado sob oftalmoscopia binocular indireta e dilatação das pupilas, entre a 4a e a 6a semana de vida, em todos os recém-nascidos com peso igual ou menor do que 1500 gramas e/ou com idade gestacional igual ou inferior a 32 semanas conforme proposto pelas Diretrizes Brasileiras de Triagem e Detecção da ROP. O acompanhamento das crianças com ou sem retinopatia deverá seguir periodicamente até a normalização da vascularização da retina temporal na zona III e deverá ser mantido pelos primeiros anos de vida para a prevenção da ambliopia e do estrabismo e para a correção das altas ametropias relacionadas com a prematuridade.
Palavras-chave: Retinopatia da prematuridade: Cegueira: Prevenção & controle: Prevalência
ABSTRACT
This study discusses current aspects regarding retinopathy of prematurity (ROP), a clinical disorder that leads to the highest number of children in the world becoming blind. This emphasizes the importance of screening for the disease in all preterm infants with a very low birth weight, identifying retinopathy at a proper time, and treating it using laser at about 37 weeks post-conception while there is still a chance for treatment, which should preferably be conducted during the child stay at the Neonatology Center. The first ophthalmic examination should be performed using binocular indirect ophthalmoscopy, with dilated pupils, between 4 and 6 weeks after birth in all newborns weighing 1,500 g or less and/or at the gestational age of 32 weeks or less, as proposed by the Brazilian Guidelines for ROP Screening and Detection. The follow-up of children with or without retinopathy should be conducted periodically until vascularization of Zone 3 temporal retina is normalized, and this normalization should be maintained during the first years of life for the prevention of amblyopia and strabismus and for the correction of refractive errors related to prematurity.
Keywords: Retinopathy of Prematurity; Blindness; Prevention & control; Prevalence
INTRODUÇÃO, CONCEITUAÇÃO DA DOENÇA E REVISÃO DA LITERATURA
Descrita há mais de 50 anos, a retinopatia da prematuridade (ROP) tornou-se uma das maiores causas de cegueira infantil em todo o mundo. A ROP, em sua evolução natural, gera um elevado custo social e financeiro para toda a comunidade, por causar dano irreversível à visão prejudicando, também, o desenvolvimento cognitivo e psicomotor da criança afetada. 1,2,3
A ROP foi descrita inicialmente por Terry em 1942 com o nome de fibroplasia retrolental (FRL). Este autor identificou um crescimento anormal de tecido fibroblástico e de vasos sangüíneos justapostos posteriormente ao cristalino, causando cegueira bilateral em crianças nascidas prematuras. Entre 1942 e 1945, Terry publicou um total de 117 casos de cegueira entre prematuros sobreviventes.4,5 Uma década depois, a FRL era a maior causadora de cegueira entre crianças, tendo Silverman estimado que, entre 1943 e 1953, mais de 7.000 crianças nascidas pré-termo teriam ficado cegas pela doença nos Estados Unidos. 6
À medida em que novos conhecimentos sobre a patogênese da doença foram se acumulando, o termo FRL foi gradualmente abandonado e Health, em 1951, foi o primeiro autor a denominar essa entidade de retinopatia da prematuridade. 7
O relacionamento da doença com o uso do oxigênio, vital para a sobrevivência dos nascidos pré-termo, foi evidenciado por Campbell, na Austrália, em 1951, 8 e por Crosse e Evans, na Inglaterra, em 1952.9 Esses trabalhos sugeriram que o uso indiscriminado do oxigênio, logo após o nascimento prematuro, estava relacionado com o aparecimento da ROP, e produziram um efeito imediato em todo o mundo e, entre 1951 e 1960, uma grande restrição ao uso do oxigênio pós-natal levou à falsa impressão de que a ROP estivesse controlada. Esse período, em que ocorreu uma diminuição real nos casos de cegueira pela doença, coincidiu, também, com maior mortalidade ou aumento das co-morbidades entre os nascidos pré-termo sobreviventes. Cross estimou, em 1973, que, para cada caso de cegueira pela ROP que foi prevenido, ocorreram 16 casos de óbito entre nascidos pré-termo nos Estados Unidos. 10
O período transcorrido entre a identificação da ROP e o início dos anos 60, ficou conhecido como a “primeira epidemia da ROP”. No período entre 1960 e 1970, ocorreu uma maior liberação ao uso do oxigênio nas Unidades de Terapia Intensiva Neonatal (UTIN) e, novamente, apareceram muitos casos da doença, coincidindo com um aumento importante na sobrevivência de prematuros. Esse período ficou conhecido como “a segunda epidemia da ROP”. A partir dos anos 80, tem sido identificada pela comunidade científica internacional uma “terceira epidemia da ROP” com essa entidade passando a ser considerada a maior causadora de cegueira infantil em todos os países de economia em crescimento em função de um aumento acentuado na sobrevivência de pré-termos de muito baixo peso (PMBP: nascidos com peso ≤ 1.500 gramas), mas, especialmente, pela maior sobrevivência conseguida entre os prematuros de extremo baixo peso (PEBP: nascidos com peso ≤ 1.000 gramas). 11,12,13
EPIDEMIOLOGIA DA ROP NO BRASIL
A ROP tem sido considerada uma das maiores causas de cegueira infantil nos países de economia ascendente, dentre os quais, encontra-se o Brasil. 11,13 Nos anos mais recentes, devido à maior disponibilidade de hospitais habilitados ao atendimento de gestantes de risco e pela melhora na qualidade assistencial, houve um aumento da sobrevivência de PEBP de 8% para em torno de 35% na maioria dos países em desenvolvimento. 13
Existem muitos estudos de base institucional que permitem um entendimento adequado do comportamento da ROP em nosso país. Moraes e cols., em 1995, analisaram prospectivamente uma população de 1.342 prematuros com PN ≤ 2.100 gramas e com idade gestacional (IG) ao nascimento ≤ 37 semanas, nascidos em São Paulo e detectaram 28% de ROP em toda a coorte, sendo que 80% de ROP em qualquer estadiamento ocorreu entre bebês nascidos com PN ≤ 1.000 gramas, além de 42% de ROP entre os bebês nascidos com IG ≤ 29 semanas. 14 Bonotto e cols., em estudo realizado em Joinville SC, na Região Sul do Brasil publicado em 2007, com dados de 286 prematuros com IG ≤ 37 semanas ao nascimento, registrou 20% de prevalência da ROP em qualquer estadiamento.15 Schumann e cols., em 2009, relataram dados de ocorrência da ROP na ordem de 53,4% entre 73 pacientes com PN ≤ 1.500 gramas e/ou IG ≤ 32 semanas no Rio de Janeiro. 16 Estudo de Pinheiro e cols., realizado em Natal RN, na Região Nordeste do Brasil, mostrou dados de 663 prematuros nascidos com PN ≤ 1.500 gramas e/ou com IG ≤ 36 semanas e registrou a incidência de ROP na ordem de 62,4%, no período entre 2004 e 2006. 17 Fortes Filho e cols., em Porto Alegre RS, Região Sul do Brasil, publicaram vários estudos prospectivos com a inclusão e a coleta de dados dos pacientes obtidos de acordo com as Diretrizes Brasileiras do Exame e do Tratamento da ROP, publicadas em 2007. 18 A prevalência de ROP em qualquer estadiamento, a partir do ano de 2002, em bebês com PN ≤ 1.500 gramas e/ou IG ≤ 32 semanas (PMBP), foi relatada na ordem de 25% enquanto a prevalência da ROP grave necessitando de tratamento (ROP em doença limiar ou ROP pré-limiar do tipo 1) foi relatada na ordem de 5%. Quando considerados os bebês com PN e IG abaixo de 1.000 gramas e de 28 semanas (PEBP) a ocorrência da ROP mostrou-se muito mais elevada, atingindo a ordem de 45% e de 17%, respectivamente para ROP em qualquer estadiamento e para a ROP grave, necessitando de tratamento.19,20,21,22 Essas variações importantes na prevalência da ROP, observadas nos diversos estudos publicados no Brasil, refletem as grandes diferenças regionais existentes entre nossa população assim como demonstram diferenças consideráveis nos cuidados gerais de neonatologia como são praticados em nosso país.
No Brasil, calcula-se que mais de 15 mil nascidos prematuros, sobreviventes a cada ano, estão dentro do grupo de risco para o aparecimento da ROP (PN ≤1.500 gramas e/ou IG ≤32 semanas), gerando uma expectativa de cegueira pela doença entre 500 a 1.500 pacientes, por ano, em nosso país. 22,23
PATOGÊNESE DA ROP
A patogênese da ROP ainda não está totalmente esclarecida. Desde 1942, quando a doença foi identificada, e depois, durante muitos anos, pensou-se que os elevados níveis de oxigênio oferecidos aos prematuros teriam papel crucial, agindo isoladamente no surgimento da doença. Patz e cols., 24 em estudos clínicos prospectivos e controlados, demonstraram, claramente, a relação de causa e efeito entre o uso de oxigenioterapia em ventilação mecânica e o aparecimento da ROP, contudo a doença continuou ocorrendo, mesmo após cuidadoso controle sobre a administração de oxigênio nos berçários. O nível de segurança no uso da oxigênioterapia em prematuros ainda não foi suficientemente comprovado nos dias de hoje apesar de estar amplamente demonstrado que o contínuo monitoramento do uso do oxigênio reduz a incidência da ROP. Esses fatos caracterizam a ROP como uma doença de causa multifatorial.25
25
Durante o processo de formação embrionária do olho, a vascularização da retina nasal completa-se ao redor da 32ª semana de IG, enquanto a vascularização da retina temporal completa-se ao redor da 40a semana após a concepção, ou logo após o nascimento a termo. A ROP pode surgir, portanto, quando ocorre uma interrupção no processo da vasculogênese natural retiniana em função do nascimento prematuro. 26
OS FATORES VEGF, IGF-I E O DESENVOLVIMENTO DA ROP
A ROP é uma doença ocular vasoproliferativa secundária à vascularização inadequada da retina, que ocorre em pré-termos cujas retinas ainda são imaturas ao nascimento. Após o nascimento prematuro, o oxigênio suplementar a que o bebê é submetido leva a uma situação de hiperóxia que desencadeia vaso-constrição, obliteração vascular, isquemia periférica e interrupção definitiva da formação vascular retiniana. A hiperóxia, se mantida por um maior período de tempo, causa superprodução do fator de crescimento do endotélio vascular (vascular endothelial growth factor, VEGF), que estimula a neovascularização indesejada da retina e o aparecimento das demais complicações da ROP. 26
A ROP é uma doença que se forma em duas fases e sua ocorrência está relacionada com o VEGF, fator regulado pelo oxigênio, e com o fator de crescimento insulin-like-I (insulin-like growth factor-I, IGF-I), fator não regulado pelo oxigênio.27 Em pacientes que desenvolverão a ROP, o crescimento dos vasos retinianos periféricos torna-se mais lento ou fica interrompido definitivamente após o nascimento prematuro, deixando a retina periférica avascular e hipóxica (Fase 1 da ROP). A fase proliferativa da doença (Fase 2 da ROP) se dá em função dessa isquemia. A extensão total da falta de perfusão da retina na fase inicial da ROP parece determinar o grau subseqüente de neovascularização, ou seja, da gravidade da doença que pode levar ao descolamento da retina e à cegueira irreversível.27,28
O VEGF é um potente fator angiogênico necessário para o crescimento normal dos vasos sangüíneos, mas está, ao mesmo tempo, associado com a neovascularização indesejada, tanto da retina quanto da íris. Quando ocorre o nascimento prematuro, a expressão de VEGF é reduzida. Acredita-se que esse fenômeno se deve à hiperóxia a que o bebê é submetido. Conforme a retina amadurece e se torna hipóxica, devido à parada do crescimento vascular, os níveis de VEGF aumentam progressivamente até provocarem, em alguns pacientes, a neovascularização indesejada da retina (Fase 2 da ROP). A inibição do VEGF, nessa fase, não previne, porém, completamente a neovascularização retiniana da ROP, mostrando que essa é uma doença multifatorial. 27
Nos anos mais recentes, muitos trabalhos têm mostrado a relação entre o fator IGF-I e o surgimento da ROP. A primeira relação do IGF-I com a ROP foi demonstrada quando se determinou que esse fator controlava a ativação máxima do VEGF. Hellström e cols. demonstraram que níveis muito baixos de IGF-I preveniram a ativação in vitro da proteína quinase-B, criticamente envolvida na manutenção da sobrevivência celular endotelial. Esses achados explicam como a perda de IGF-I pode causar a doença, prevenindo a sobrevivência normal das células endoteliais.27 Essas observações foram confirmadas em pacientes com ROP. Hellström e cols. relataram que, em prematuros, os níveis séricos de IGF-I, no período imediatamente posterior ao nascimento, foram significativa e proporcionalmente menores nos bebês que desenvolveram ROP do que naqueles que não a desenvolveram. 28 Villegas-Becerril e cols. verificaram que, em prematuros com PN ≤ 1.500 gramas e IG ≤ 32 semanas, os níveis séricos de IGF-I, medidos entre as primeiras 4 a 6 semanas de vida, foram muito mais baixos nos prematuros com ROP, quando comparados com os que não desenvolveram a doença e sugeriram que o fator IGF-I pode ser um indicador nas triagens para a ROP. 29
O fator IGF-I é necessário para o desenvolvimento normal da vascularização retiniana. Esse fator, quando em baixo nível sérico, inibe a vascularização natural na retina e, quando em excesso, estimula a neovascularização (Fase 2 da ROP). Especula-se que baixos valores séricos de IGF-I, nas primeiras semanas após o nascimento prematuro, estejam relacionados à maior chance de desenvolvimento posterior da ROP. O período de duração do IGF-I baixo, medido no soro do nascido pré-termo, poderia se relacionar com a gravidade da doença. 30,31
FATORES DE RISCO PARA A OCORRÊNCIA DA ROP
Nem todos os bebês nascidos prematuramente desenvolvem ROP. Existem muitos fatores que poderiam desencadear o aparecimento da ROP e suas graves complicações. A oxigenioterapia, desde vários anos, já não tem sido considerada o único ou o principal fator de risco (FR) para a ocorrência da ROP. A ROP se comporta como uma entidade multifatorial, sendo o uso do oxigênio apenas um dos vários fatores envolvidos no seu aparecimento. A influência de outros fatores, como um todo, ainda não está perfeitamente definida atualmente. 32
A ROP afeta mais freqüentemente os prematuros menores e os clinicamente mais debilitados, mas pode ocorrer, também, em pré-termos de maior PN. Ainda não está suficientemente demonstrado se as formas mais graves da doença estão associadas com as intervenções terapêuticas necessárias para a manutenção da vida do paciente nascido pré-termo ou com a gravidade das comorbidades associadas com a prematuridade. 33
Muitos FR para o surgimento da ROP têm sido estudados ao longo dos últimos cinquenta anos e diferentes causas, tanto pré quanto pós-natais, foram propostas para explicar o aparecimento da doença entre prematuros: infecção viral ou bacteriana primária ou transmitida pela mãe ao RNP, deficiências de vitamina E, de ferro ou deficiências hormonais, anoxia, anemia e hipercapnia; 34 porém a menor idade gestacional (imaturidade geral), a debilidade do estado físico da criança prematura, o baixo PN e o uso prolongado de oxigenioterapia, têm sido os mais consistentemente relacionados com o surgimento da doença. 33,34
O uso materno pré-natal de esteróides e beta-bloqueadores, a exposição do bebê à luz intensa nos berçários, o uso de corticoides, indometacina, surfactante e eritropoetina, a situação de gemelaridade, a necessidade de tratamento do ducto-arterial, a presença de hemorragia intracraniana, as apneias recorrentes, as transfusões sanguíneas, a imunossupressão, a presença concomitante de infecções e o uso de antibióticos também foram relacionados com o surgimento da ROP. 35
A presença de hemorragia intracraniana (HIC) em qualquer estadiamento evolutivo tem sido mencionada como um FR para a ROP. Procianoy e cols., em 1981, relataram uma associação significativa entre ROP cicatricial e a ocorrência de HIC ao estudarem 138 PMBP. 36 Christiansen, em 2002, relatou uma associação significativa entre o grau da HIC e o estadiamento da ROP numa coorte de 60 PMBP, na qual 17 pacientes desenvolveram HIC em estadiamentos Graus III e IV e 49 desenvolveram apenas HIC Graus 0 a II. Sessenta e quatro por cento dos RNP que desenvolveram graus avançados de HIC apresentaram estadiamentos de ROP 3 ou pior. 37
Fatores pré-natais que pudessem interferir na saúde geral dos pacientes e no consequente desenvolvimento da ROP, também foram estudados. Entre eles, o uso de corticoides ou beta-bloqueadores no período pré-parto e a idade materna, por ocasião do parto, em função da crescente maternidade de jovens pré-adolescentes, especialmente nos países em desenvolvimento. 38 A ocorrência de pré-eclampsia entre as mães foi demonstrada como criando um fator de proteção aos nascidos prematuros no que tange ao desenvolvimento posterior da ROP grave. 39
O baixo ganho ponderal (GP), após o nascimento pré-termo como possível FR para o surgimento da ROP, tem sido reportado na literatura científica apenas mais recentemente.O primeiro estudo que relacionou o GP no período pós-natal com a ROP em uma série de pacientes foi publicado por Wallace e cols., no ano 2000. Os autores coletaram retrospectivamente dados de GP pós-natal e de mais 11 outros FR e sugeriram que o GP abaixo de 50% sobre o PN, nas primeiras seis semanas de vida, poderia indicar um importante FR para o aparecimento da ROP em suas formas mais graves (estadiamentos 3, 4 ou 5). 40 Fortes Filho e cols., analisaram prospectivamente o baixo GP no período posterior ao nascimento e sua importância prática como um fator preditivo para o surgimento da ROP. O estudo, publicado em 2009, demonstrou, pela análise das curvas ROC (em relação à sensibilidade e especificidade do GP), a capacidade de que a ocorrência da ROP possa vir a ser prevista, ao se analisar a evolução do GP após o nascimento prematuro sendo esse fato de grande importância e praticidade no dia a dia do oftalmologista.41 Modernamente, vários estudos apontam, ainda, para uma eventual predisposição genética para o surgimento da ROP nos pacientes pré-termo. 42
CLASSIFICAÇÃO INTERNACIONAL DA ROP
A Classificação Internacional da ROP, desenvolvida a partir de 1984, por um grupo que se tornou conhecido como The Committee for the Classification of Retinopathy of Prematurity, foi revisada em 1987 e 2005. A Classificação Internacional localiza a doença em um mapa da retina, dividido em três zonas e descreve sua extensão de acordo com os meridianos envolvidos, contados em horas do relógio (Figura 1). As alterações evolutivas da ROP estão classificadas em cinco estadiamentos, a saber:
Estadiamentos da doença
• Estadiamento 1 : isquemia retiniana periférica com presença de linha de demarcação entre a retina vascularizada e a retina isquêmica;
• Estadiamento 2: alargamento da linha de demarcação e presença de uma crista elevada sobre a região periférica da retina;
• Estadiamento 3: presença de proliferação fibrovascular retiniana ou extra retiniana sobre as áreas das cristas elevadas;
• Estadiamento 4A: presença de descolamento tracional parcial periférico da retina que não afeta a região macular;
• Estadiamento 4B: presença de descolamento tracional parcial da retina que afeta a região macular, e
• Estadiamento 5: presença de descolamento total da retina complicado por proliferação de tecido fibroso ou retrolental.
Mapa para a localização da doença nas zonas de envolvimento da retina
O mapa criado em 1984 (Figura 1) é composto de dois círculos concêntricos, tendo a papila óptica como centro. Um terceiro círculo de forma semilunar era posicionado no setor temporal. O conjunto dos círculos limitava três zonas diferentes do FO centradas na papila óptica. Esses três círculos delimitavam as chamadas zonas de envolvimento da doença:
• Zona I (zona do pólo posterior): centralizada a partir da papila atinge seu limite a uma distância equivalente a duas vezes a distância entre a papila e a mácula, em todas as direções;
• Zona II (zona equatorial): atinge seu limite tangenciando a ora serrata, no lado nasal, e a uma extensão equivalente à zona equatorial no setor temporal e
• Zona III (zona periférica temporal): área de forma semilunar situada externamente à Zona II no setor temporal. Essa é a zona em que mais tardiamente se completa a vascularização da retina nos prematuros, sendo, portanto, a zona mais frequentemente envolvida na ROP.
Extensão da doença
Definiu-se que a extensão da doença seria mensurada em horas do relógio. Quando se olha o mapa do FO, o meridiano das 3 horas está localizado no lado nasal do olho direito e no lado temporal do olho esquerdo.
Conceito de doença plus
Diz-se que um bebê prematuro apresenta ROP com doença plus quando se identifica, no FO, importante dilatação e tortuosidade dos vasos retinianos venosos ou arteriais, desde a periferia até o polo posterior (Figura 2). Poderá ocorrer, nesse momento, turvação discreta no vítreo, alterações vasculares na íris e dificuldade em se conseguir uma boa dilatação das pupilas. O significado clínico desses achados é o de ROP em progressão, com risco aumentado de perda visual no bebê afetado. A ocorrência da doença plus é considerada como o evento mais importante e indicativo imediato para o tratamento de um paciente portador da ROP.43,44,45
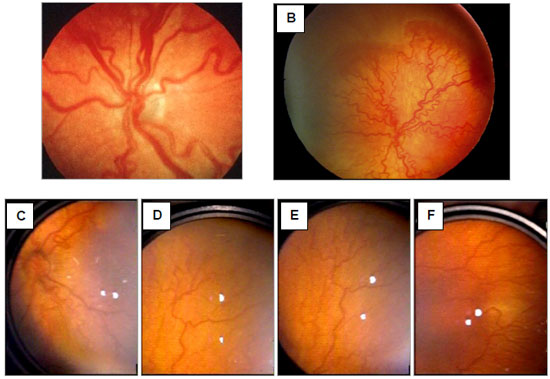
Em 2005, novas modificações foram incluídas na classificação internacional, com a introdução do conceito de ROP doença agressiva posterior (rush disease ou agressive posterior ROP), observada especialmente entre PEBP. Foi, também, estabelecido o conceito de um nível intermediário da doença plus (pre-plus disease), além de uma maneira de se estimar facilmente a extensão da Zona I, quando se faz a oftalmoscopia indireta com a lente de 28 dioptrias. 45 As classificações atualizadas da ROP estão apresentadas no Quadro 1.
DIAGNÓSTICO DA ROP NOS EXAMES DE TRIAGEM
Os programas de triagem oftalmológica para a detecção da ROP, com exames de FO sistematicamente realizados nas UTIN, nos prematuros nascidos no grupo de risco para o surgimento da ROP, são a melhor possibilidade de se diagnosticar a doença para o tratamento adequado antes da progressão natural para os estadiamentos mais avançados. Os critérios de inclusão nos chamados grupos de risco variam entre diferentes países e são baseados no PN e na IG. 46
No Brasil, desde 2007, ficou proposto nas Diretrizes para a Triagem de Detecção e Tratamento da ROP que os exames para a detecção precoce da ROP seriam realizados em todos os prematuros com PN < 1.500 gramas e/ou IG < 32 semanas ao nascimento.
0 exame oftalmológico inicial seria realizado entre a 4ª e a 6ª semana de vida, utilizando-se oftalmoscopia binocular indireta (OBI) e dilatação das pupilas. Poderiam, ainda, ser incluídos, nas triagens, todos os bebês com maior PN ou com maior IG que estivessem sob risco de desenvolver a doença em função de suas condições clínicas, quando solicitado pelo neonatologista responsável. 18
Exame clínico
O exame oftalmológico em todos os pacientes deve ser feito sempre com OBI, após dilatação das pupilas com a associação dos colírios tropicamida 0,5% e fenilefrina 2,5%, instilados por 3 vezes, com intervalo de 5 minutos entre as instilações, antes do exame. Podem ser usadas lentes de 20, 28 ou de 30 dioptrias. Blefarostatos para recém-nascidos, especialmente o de Alfonso (Alfonso Eye Speculum (Storz®, EUA), e indentação escleral podem ser utilizadas para facilitar a observação de anormalidades na Zona III. Anestesia tópica da superfície ocular com uma gota de colírio de cloridrato de proximetacaína 0,5% é aconselhável.
As diretrizes brasileiras orientam que as avaliações oftalmológicas devem se iniciar entre a 4a e a 6a semana de vida e precisam ser repetidas conforme os achados do exame inicial, a saber: retina madura (vascularização completa): seguimento com 6 meses; retina imatura (vascularização não completa) ou presença de ROP <pré-limiar: avaliação de 2/2 semanas; retinopatia em regressão: avaliação de 2/2 semanas; retina imatura em Zona I: exames semanais; ROP pré-limiar do tipo 2: exames entre 3 e 7 dias; ROP pré-limiar do tipo 1 (Zona I, qualquer estadiamento com plus; Zona I, Estadiamento 3; Zona II, Estadiamento 2 ou 3 plus) e ROP limiar: tratamento em até 72 horas desse diagnóstico e, finalmente, indicam que a interrupção dos exames somente deve se dar quando a vascularização da retina estiver completa ou o bebê atinja a IG corrigida acima de 45 semanas e ausência de ROP pré-limiar ou quando ocorrer a ROP em forma completamente regredida. 18
Exames complementares que podem ser de utilidade
Na maior parte das vezes, o diagnóstico da ROP é quase que totalmente feito com base na identificação da doença pelo exame da criança na UTIN com o OBI, uma técnica que requer muito treinamento do examinador para seu uso nos prematuros. Modernamente outros métodos têm sido utilizados objetivando complementar ou facilitar a triagem na busca da doença, entre eles a angiografia fluoresceínica, a ecografia, a tomografia de coerência óptica, a medida da velocidade do fluxo circulatório na artéria central da retina pelo Dopller e a documentação do FO por RetCam, telefones celulares com câmera fotográfica, além do uso da telemedicina.
Angiografia Fluoresceínica
Ainda é um método semiológico de uso muito pouco prático em bebês prematuros a não ser que possa ser realizado com o equipamento conhecido como a RetCam 120 (Massie Research Laboratories, Dublin CA, USA) que foi especialmente desenvolvido para uso em oftalmopediatria. Esse equipamento permite uma ótima visão do fundo de olho em campos de grande angulação que alcançam a periferia da retina nos 360°. Desse modo, os fenômenos isquêmicos e neovasculares que ocorrem na ROP podem ser totalmente documentados o que torna esse equipamento de valor inestimável para o combate à cegueira pela ROP. A RetCam é um equipamento versátil, computadorizado e que está sendo utilizado em todo o mundo nos programas de telemedicina relacionados com a ROP. A RetCam pode incorporar filtros de excitação e de bloqueio necessários aos exames de angiografia fluoresceínica. O corante, fluoresceína sódica na concentração de 20%, pode ser injetado intravenosamente numa dose de 0,04 ml/kg do peso corporal (8 mg/kg) seguida por uma quantidade de soro fisiológico para que possa ser obtido um volume adequado do mesmo na circulação sanguínea do bebê. As complicações que podem acontecer nos exames angiofluoresceinográficos em adultos podem, também, acontecer em pacientes pré-termo e todos os cuidados de emergência precisam estar disponíveis para que esse exame possa vir a ser feito nesse grupo de pacientes, porém estudos já realizados relataram que o uso da angiografia fluoresceínica é um procedimento seguro nos pacientes nascidos pré-termo. 41,48
A maior vantagem da angiografia fluoresceínica seria a de possibilitar uma visão mais fácil da vascularização periférica da retina que pode não ser claramente identificada nos exames tanto com o OBI quanto com a RetCam sem o uso do corante endovenoso. A angiografia pode ser útil para a identificação mais perfeita do polo posterior e da região macular em pacientes portadores de ROP grave em zona I e, ainda, para se definir a extensão total do laser necessário para um adequado tratamento, especialmente se a ROP estiver localizada nas zonas I ou na zona II posterior. Também teria utilidade na identificação de áreas que tenham ficado sem a devida fotocoagulação naqueles pacientes cuja doença plus ainda persistir por mais de 20 dias após o tratamento inicial com o laser. A persistência da doença plus após esse período seria um indício da necessidade de tratamento complementar pelo laser.
Ultrassonografia
A ultrassonografia, com sondas de 10 ou de 20 MHz, já vem sendo utilizada rotineiramente desde muitos anos nos pacientes portadores de ROP em estadiamentos 4 e 5, especialmente para o planejamento de cirurgias reparadoras do descolamento da retina. Através da ecografia se pode verificar as condições de aderência dos folhetos retinianos descolados na forma de funil aberto ou fechado tanto anteriormente quando posteriormente. As trações e opacificações do vítreo, o aumento da espessura da coroide e a redução do comprimento anteroposterior do globo ocular podem ser muito bem identificados pelo ultrassom, possibilitando que se estabeleça um prognóstico de re-aplicação da retina após procedimentos cirúrgicos. 49
É importante mencionar que o comprimento axial do globo ocular nos bebês que atingem ROP em estadiamentos finais após a 39ª ou 40a semana de idade pós-concepção é de 16 a 17 mm, em média e que as sondas ultrassonográficas são planejadas para alcançarem um plano focal na retina num olho com comprimento axial entre 24 a 30 mm. Isso gera uma redução na capacidade de resolução da ecografia nas estruturas retinianas ou pré-retinianas nos pacientes prematuros. Por essa razão muitos pesquisadores recomendam que a ultrassonografia em prematuros seja feita com uma câmara líquida interposta entre a ponteira do transducer e a córnea para que o plano da retina fique dentro do campo de maior resolução da sonda, ao redor de 24 a 30 mm. Essa câmara líquida poderia ser obtida com o dedo de uma luva cirúrgica preenchido com água destilada.50,51,52
Ecografia Doppler da Artéria Oftálmica
As medidas da velocidade do fluxo circulatório na artéria oftálmica através da ecografia com Doppler vem sendo testada em vários estudos com o objetivo de determinar seus parâmetros de normalidade em pacientes nascidos prematuros com ou sem ROP.53,54,55,56 É um método que exige equipamento de ecografia sistêmica de alto custo, mas que está disponível em muitos hospitais de nível 3. Exige, também, muito conhecimento técnico e habilidade no examinador para a adequada identificação da artéria oftálmica em pacientes muito pequenos.
Em nossa UTIN do HCPA utilizamos o equipamento LOGIC 5 (GE Healthcare, Little Chalfont, Buckinghamshire, UK) com uma sonda 7,5 MHz como transducer num estudo com 85 pacientes prematuros com PN ≤ e/ou IG ≤ 32 semanas; realizamos medidas semanais desde a primeira semana de vida até a alta da UTIN para a determinação longitudinal dos valores do fluxo circulatório na artéria oftálmica entre PMBP que não desenvolveram a ROP. Determinamos que a velocidade sistólica variou significativamente de 17,85 ± 5,30 cm/s no exame inicial (1a semana de vida) para 23,51 ± 5,63 cm/s por ocasião da alta hospitalar e que a velocidade diastólica variou, também significativamente, de 6,17 ± 1,13 cm/s a 6,94 ± 1,53 cm/s durante as semanas que se sucederam ao nascimento prematuro. Em posse desses valores de normalidade, determinados de modo longitudinal em PMBP, haveria a necessidade de se estabelecer valores de velocidade de fluxo circulatório na artéria central da retina nos PMBP que desenvolvessem a ROP em estadiamento 3, doença limiar ou a ROP pré-limiar do tipo 1, para sabermos se o uso da ecografia doppler nesses pacientes poderia predizer a necessidade de tratamento posterior da ROP grave. 53
Tomografia de Coerência Óptica (OCT)
A tomografia de coerência óptica (OCT) é um importante método semiológico introduzido mais recentemente na Oftalmologia. Oferece muitas informações especialmente sobre as regiões maculares e papilares. Permite que a retina e a região macular sejam estudadas em cortes transversais desde a interface vítreorretiniana, membrana limitante interna e demais camadas retinianas, complexo membrana de Bruch / epitélio pigmentar e a coriocapilar.
Em pacientes portadores de ROP estadiamentos 2 ou 3, o OCT permite exame muito detalhado das condições anatômicas da região macular, verifica a a presença de trações vítreo-retinianas e a presença de edema intrarretiniano, possibilitando estabelecer um prognóstico em relação à futura capacidade de visão do paciente tratado pelo laser.
Foi relatada a ocorrência de uma anatomia macular e foveal preservada como ocorrendo em não mais do que 25% dos pacientes afetados pela ROP estadiamentos 2 ou 3. Em pacientes portadores de ROP em estadiamentos mais avançados, ROP 4A ou B e nos portadores de ROP 5 que necessitam tratamento cirúrgico, o OCT sempre mostra alterações anatômicas importantes e permite definir estratégias pré-operatórias para que se procure a melhor alternativa cirúrgica caso a caso. O OCT sempre permite estabelecer um prognóstico de recuperação visual após os procedimentos. 57,58
DIAGNÓSTICO DIFERENCIAL
As principais doenças vitreorretinianas congênitas a serem consideradas no diagnóstico diferencial da ROP são: a Síndrome de Norrie, de herança recessiva ligada ao sexo, e a Vitreorretinopatia Exsudativa Familiar, de herança autossômica dominante. Ambas são anomalias da formação e do desenvolvimento da retina podendo mostrar aspectos de FO muito parecidos com as fases mais avançadas da ROP. A grande pista para o diagnóstico diferencial entre a ROP e essas entidades é que estas ocorrem, geralmente, em crianças nascidas a termo. 59
A principal doença adquirida a ser considerada no diagnóstico diferencial da ROP cicatricial ou regressiva é a Toxocaríase Ocular com desorganização vitreorretiniana, especialmente quando ocorre a formação de traves vítreas e granulomas periféricos. Para esse diagnóstico diferencial, usa-se o Teste de ELISA para a toxocaríase.
TRATAMENTO DA ROP
A crioterapia da retina avascular periférica foi o tratamento padrão para a ROP classificada como doença limiar, a partir de 1988, em função dos resultados do Multicenter Trial of Cryotherapy for Retinopathy of Prematurity (CRYO-ROP), o qual confirmou que esse tratamento preveniu a progressão da ROP em um número significativo de pacientes. 60 A crioterapia, modernamente, perdeu espaço para o laser aplicado através da OBI como método de escolha para o tratamento da ROP. Os resultados do tratamento pela fotocoagulação transpupilar, tanto com o laser argônio quanto com o laser diodo, são bons, e se consegue deter a progressão natural da ROP na grande maioria dos pacientes tratados. O tratamento da ROP pela fotocoagulação transpupilar pelo laser precisa ser feito quase sempre ao redor da 37a semana de idade pós-concepção (IPC: Idade pós-concepção = idade gestacional + semanas de vida) momento em que a ROP atinge a evolução mais perigosa (ROP limiar) ou na 36a semana de IPC, momento em que ocorre a ROP pré-limiar do tipo 1. Tratamentos realizados posteriormente a essas semanas de IPC, usualmente, tem pior prognóstico para a manutenção de uma qualidade de visão no paciente afetado. 61
A fotocoagulação pelo laser pode ser feita tanto no centro cirúrgico sob anestesia geral quanto na UTIN sob sedação controlada pelo neonatologista. Os impactos de laser devem ser dirigidos à retina periférica isquêmica por fora da crista de demarcação entre a retina vascularizada e a retina avascular e devem ser aplicados de forma confluente, ou seja: marcas de impacto do laser muito próximas umas das outras para não restar áreas de isquemia sem cobertura de impactos do laser (Figura 3). A intensidade da queimadura do laser deve ser suficiente para produzir uma lesão de coloração esbranquiçada na retina avascular. Se a doença plus persistir por mais de 14 a 21 dias do tratamento deverá ser considerada a necessidade de um segundo tratamento com o laser. Essa necessidade ocorre num percentual entre 10 a 15% das vezes e depende muito do treinamento e da experiência do oftalmologista encarregado de praticar esse tratamento em bebês prematuros com instabilidade clínica importante.
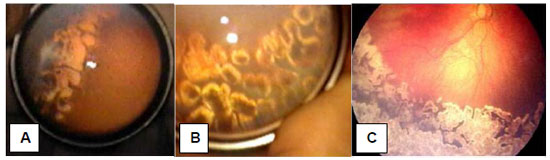
Na tentativa de melhora dos desfechos visuais e com uma abordagem mais direcionada à fisiopatologia da doença, desde 2009, muitos autores buscaram a utilização de medicações anti-VEGF para o tratamento da ROP grave. Depois de serem publicados inúmeros relatos ou séries de casos com resultados animadores do tratamento da ROP pelo bevacizumab (Avastin), o estudo BEAT-ROP, em 2011, demonstrou melhor eficácia do bevacizumab em avaliação multicêntrica, prospectiva e randomizada no tratamento da ROP em estadiamentos ROP 3 com doença plus em zona I quando comparado com a fotocoagulação pelo laser.62 Desde então, muitos trabalhos têm sido publicados demonstrando sucesso tanto do bevacizumab quanto do ranibizumab no tratamento da ROP grave tanto como tratamento inicial da ROP quanto para complementação do tratamento após uma fotocoagulação inicial nos paciente com ROP grave em zona I e, também, nos pacientes com ROP grave em zona II posterior. É de grande importância mencionar que o momento ideal para a realização de tratamento por injeção intravítrea de anti-VEGF deve ser na 35a ou 36a semana de IPC quando a maior quantidade de VEGF está sendo liberada na retina periférica, portanto um pouco antes do momento considerado ideal para o tratamento pelo laser. Tratamentos por anti-VEGF realizados em semanas posteriores à IPC 35 ou 36 podem ter consequências devastadoras sobre a retina, especialmente se o tecido fibrótico já estiver sendo identificado ao exame do FO.63,64,65,66
PROGNÓSTICO APÓS O TRATAMENTO DA ROP
A ROP habitualmente regride na maioria dos pacientes que desenvolvem apenas os estadiamentos 1 ou 2, pois a vascularização da retina periférica pode ir se completando nas semanas seguintes ao nascimento prematuro, deixando poucas alterações anatômicas e funcionais residuais que não necessitam de nenhum tratamento específico. Esses pacientes precisam apenas de acompanhamento evolutivo, durante os primeiros anos de sua vida, para a prevenção de ambliopia e do estrabismo e para a correção de ametropias, cujas incidências parecem ser maiores em RNP, quando comparadas com nascidos não prematuros. 67
Quando a ROP atinge estadiamento 3 e doença limiar ou estadiamentos 2 ou 3 e doença pré-limiar do tipo 1, o bebê necessita de tratamento, pois sabe-se que 50% dos pacientes em doença limiar e mais do que 15% dos pacientes em doença pré-limiar do tipo 1 irão apresentar desfecho anatômico e funcional desfavorável sem o adequado tratamento. 68
O prognóstico do tratamento pela fotocoagulação pelo laser diodo nos pacientes com a doença limiar é bom e se consegue evitar a perda da visão em cerca de 70 a 80% dos pacientes, nos dias de hoje.69,70 Contudo, o envolvimento da região macular pode resultar em uma acuidade visual final muito abaixo do esperado. Muitas das crianças tratadas mostram, posteriormente, acuidade visual não muito satisfatória em função de alterações anatômicas residuais que podem se localizar na região macular ou pela ocorrência de estrabismo, ambliopia ou alta ametropia. 71
Os olhos que progridem para estadiamentos ROP 4A ou B e ROP 5 e que precisam de tratamento cirúrgico mostram prognóstico anatômico e funcional muito piores, mesmo após retinopexia com introflexão escleral ou após vitrectomia via pars plicata com preservação ou não do cristalino.
Modernamente, se prematuros com risco potencial de desenvolver ROP grave pudessem ser identificados precocemente, eles poderiam receber atendimento perinatal ainda mais cuidadoso e personalizado em relação aos seus vários fatores de risco. Isso facilitaria o planejamento para a escolha do melhor momento para o tratamento oftalmológico, pois as crianças mais doentes e com um pior prognóstico pós-natal são as que estão em maior risco para o surgimento da ROP. Esse manejo perinatal mais adequado do paciente prematuro em risco de desenvolver ROP avançada poderia levar a uma eficiente prevenção das formas mais graves da doença com diminuição dos índices de ocorrência de cegueira infantil.
REFERÊNCIAS
1. Gilbert C, Rahi J, Eckstein M, O'Sullivan J, Foster A. Retinopathy of prematurity in middle-income countries. Lancet. 1997;350(9070):12-4. http://dx.doi.org/10.1016/S0140-6736(97)01107-0
2. Gilbert C, Fielder A, Gordillo L, Quinn G, Semiglia R, Visintin P, et al. Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: implications for screening programs. Pediatrics. 2005;115(5):e518-25. http://dx.doi.org/10.1542/peds.2004-1180
3. Wheatley CM, Dickinson JL, Mackey DA, Craig JE, Sale MM. Retinopathy of prematurity: recent advances in our understanding. Br J Ophthalmol. 2002;86(6):696-700. PMC1771164. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1771164/#abstractid223760title
4. Terry T. Extreme prematurity and fibroblastic overgrowth of persistent vascular sheath behind each crystalline lens. I - Preliminary report. Am J Ophthalmol. 1942;25:203-4. http://dx.doi.org/10.1016/S0002-9394(42)92088-9
5. Terry T. Fibroblastic overgrowth of persistent tunica vasculosa lentis in premature infants. II - Report of cases - clinical aspects. Am J Ophthalmol. 1943;29:36-53. PMC1315050. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1315050/pdf/taos00059-0283.pdf
6. Silverman WA. Retrolental fibroplasia: a modern parable. New York: Grune & Stratton; 1980. https://doi.org/10.1017/S0021932000013754
7. Heath P. Pathology of the retinopathy of prematurity, retrolental fibroplasia. Am J Ophthalmol. 1951 ;34:249. http://dx.doi.org/10.1016/0002-9394(51)91859-4
8. Campbell K. Intensive oxygen therapy as a possible cause of retrolental fibroplasia: a clinical approach. Med J Aust. 1951 ;2(2):48-50. https://www.ncbi.nlm.nih.gov/pubmed/14874698
9. Crosse VM. Retrolental fibroplasia. Ulster Med J. 1952;21(1):32-5. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2479972/pdf/ulstermedj00162-0042.pdf
10. Cross KW. Cost of preventing retrolental fibroplasia? Lancet. 1973;2(7835):954-6. http://dx.doi.org/10.1016/S0140-6736(73)92610-X
11. Steinkuller PG, Du L, Gilbert C, Foster A, Collins ML, Coats DK. Childhood blindness. J AAPOS. 1999;3(1):26-32. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/10071898
12. Gilbert C. Retinopathy of prematurity--the "second lull"? Br J Ophthalmol. 2001;85(9):1017-9. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1724130/pdf/v085p01017a.pdf
13. Gilbert C, Foster A. Childhood blindness in the context of VISION 2020--the right to sight. Bull World Health Organ. 2001;79(3):227-32. http://dx.doi.org/10.1590/S0042-96862001000300011
14. Moraes NSB, Bonomo PP, Almeida MFB. Retinopatia da prematuridade: estudo prospectivo de 1342 casos. Arq Bras Oftalmol. 1995;58(4 Supl):255
15. Bonotto LB, Moreira AT, Carvalho DS. Prevalence of retinopathy of prematurity in premature babies examined during the period 1992-1999, Joinville (SC): evaluation of associated risks-screening. Arq Bras Oftalmol. 2007;70(1):55-61. http://dx.doi.org/10.1590/S0004-27492007000100011
16. Schumann RF, Barbosa AD, Valete CO. Incidence and severity of retinopathy of prematurity and its association with morbidity and treatments instituted at Hospital Antonio Pedro from Universidade Federal Fluminense, between 2003 and 2005. Arq Bras Oftalmol. 2010;73(1):47-51. http://dx.doi.org/10.1590/S0004-27492010000100008
17. Pinheiro AM, Silva WA, Bessa CG, Cunha HM, Ferreira MA, Gomes AH. Incidence and risk factors of retinopathy of prematurity in University Hospital Onofre Lopes, Natal (RN)-Brazil. Arq Bras Oftalmol. 2009;72(4):451-6. http://dx.doi.org/10.1590/S0004-27492009000400005
18. Zin A, Florencio T, Fortes Filho JB, Nakanami CR, Gianini N, Graziano RM, et al. Brazilian guidelines proposal for screening and treatment of retinopathy of prematurity (ROP). Arq Bras Oftalmol. 2007;70(5):875-83. http://dx.doi.org/10.1590/S0004-27492007000500028
19. Lermann VL, Fortes Filho JB, Procianoy RS. The prevalence of retinopathy of prematurity in very low birth weight newborn infants. J Pediatr (Rio J). 2006;82(1):27-32. http://dx.doi.org/10.2223/JPED.1433
20. Fortes Filho JB, Barros CK, da Costa MC, Procianoy RS. Results of a program for the prevention of blindness caused by retinopathy of prematurity in southern Brazil. J Pediatr (Rio J). 2007;83(3):209-16. http://dx.doi.org/10.2223/JPED.1611
21. Fortes Filho JB, Eckert GU, Procianoy L, Barros CK, Procianoy RS. Incidence and risk factors for retinopathy of prematurity in very low and in extremely low birth weight infants in a unit-based approach in southern Brazil. Eye (Lond) 2009;23(1):25-30. http://dx.doi.org/10.1038/sj.eye.6702924
22. Fortes Filho JB. Retinopatia da prematuridade [artigo de revisão]. Rev Bras Oftalmol. 2006;65(4):246-58. http://hdl.handle.net/10183/71730
23. Graziano RM, Leone CR. Frequent ophthalmologic problems and visual development of extremely preterm newborn infants. J Pediatr (Rio J). 2005;81(1 Suppl):S95-100. http://dx.doi.org/10.1590/S0021-75572005000200012
24. Patz A. The role of oxygen in retrolental fibroplasia. Trans Am Ophthalmol Soc. 1968;66:940-85. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1310320/pdf/taos00033-0953.pdf
25. Lucey JF, Dangman B. A reexamination of the role of oxygen in retrolental fibroplasia. Pediatrics. 1984;73(1):82-96. Abstract disponível em: http://pediatrics.aappublications.org/content/73/1/82
26. Fielder AR, Reynolds JD. Retinopathy of prematurity: clinical aspects. Semin Neonatol. 2001;6(6):461-75. http://dx.doi.org/10.1053/siny.2001.0091
27. Hellström A, Perruzzi C, Ju M, Engstrom E, Hard AL, Liu JL, et al. Low IGF-I suppresses VEGF-survival signaling in retinal endothelial cells: direct correlation with clinical retinopathy of prematurity. Proc Natl Acad Sci USA. 2001 ;8;98(10):5804-8. http://dx.doi.org/10.1073/pnas.101113998
28. Hellström A, Engstrom E, Hard AL, Bertsson-Wikland K, Carlsson B, Niklasson A, et al. Postnatal serum insulin-like growth factor I deficiency is associated with retinopathy of prematurity and other complications of premature birth. Pediatrics. 2003;112(5):1016-20. Abstract disponível em: http://pediatrics.aappublications.org/content/112/5/1016
29. Villegas BE, Fernandez MF, Gonzalez R, Gallardo Galera JM. Serum IGF-I levels in retinopathy of prematurity. New indications for ROP screening. Arch Soc Esp Oftalmol. 2005;80(4):233-8. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+15852164
30. Hellström A, Carlsson B, Niklasson A, Segnestam K, Boguszewski M, de Lacerda L, et al. IGF-I is critical for normal vascularization of the human retina. J Clin Endocrinol Metab. 2002;87(7):3413-6. http://dx.doi.org/10.1210/jcem.87.7.8629
31. Engstrom E, Niklasson A, Wikland KA, Ewald U, Hellström A. The role of maternal factors, postnatal nutrition, weight gain, and gender in regulation of serum IGF-I among preterm infants. Pediatr Res. 2005;57(4):605-10. http://dx.doi.org/10.1203/01.PDR.0000155950.67503.BC
32. Fielder AR, Shaw DE, Robinson J, Ng YK. Natural history of retinopathy of prematurity: a prospective study. Eye (Lond). 1992;6(Pt 3):233-42. http://dx.doi.org/10.1038/eye.1992.46
33. Fortes Filho JB, Eckert GU, Valiatti FB, Santos PGB, Costa MV, Procianoy RS. The influence of gestational age on the dynamic behavior of other risk factors associated with retinopathy of prematurity (ROP). Graefes Arch Clin Exp Ophthalmol. 2010;248:893-900. http://dx.doi.org/10.1007/s00417-009-1248-6
34. Seiberth V, Linderkamp O. Risk factors in retinopathy of prematurity. a multivariate statistical analysis. Ophthalmologica. 2000;214(2):131-5. http://dx.doi.org/10.1159/000027482
35. Kim TI, Sohn J, Pi SY, Yoon YH. Postnatal risk factors of retinopathy of prematurity. Paediatr Perinat Epidemiol. 2004;18(2):130-4. http://dx.doi.org/10.1111/j.1365-3016.2003.00545.x
36. Procianoy RS, Garcia-Prats JA, Hittner HM, Adams JM, Rudolph AJ. An association between retinopathy of prematurity and intraventricular hemorrhage in very low birth weight infants. Acta Paediatr Scand. 1981;70(4):473-7. http://dx.doi.org/10.1111/j.1651-2227.1981.tb05725.x
37. Christiansen SP, Fray KJ, Spencer T. Ocular outcomes in low birth weight premature infants with intraventricular hemorrhage. J Pediatr Ophthalmol Strabismus. 2002;39(3):157-65. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+12051281
38. Darlow BA, Hutchinson JL, Henderson-Smart DJ, Donoghue DA, Simpson JM, Evans NJ. Prenatal risk factors for severe retinopathy of prematurity among very preterm infants of the Australian and New Zealand Neonatal Network. Pediatrics. 2005;115(4):990-6. http://dx.doi.org/10.1542/peds.2004-1309
39. Fortes Filho JB, Costa MC, Eckert GU, Santos PG, Silveira RC, Procianoy RS. Maternal preeclampsia protects preterm infants against severe retinopathy of prematurity. J Pediatr. 2011;158(3):372-6. http://dx.doi.org/10.1016/j.jpeds.2010.08.051
40. Wallace DK, Kylstra JA, Phillips SJ, Hall JG. Poor postnatal weight gain: a risk factor for severe retinopathy of prematurity. J AAPOS. 2000;4(6):343-7. http://dx.doi.org/10.1067/mpa.2000.110342
41. Fortes Filho JB, Bonomo PP, Maia M, Procianoy RS. Weight gain measured at 6 weeks after birth as a predictor for severe retinopathy of prematurity: study with 317 very low birth weight preterm babies. Graefes Arch Clin Exp Ophthalmol. 2009;247(6):831-6. http://dx.doi.org/10.1007/s00417-008-1012-3
42. Hiraoka M, Shastry BS. Evaluation of the prothrombin gene polymorphism in patients with advanced retinopathy of prematurity. Genet Test. 2000;4(1):75-7. http://dx.doi.org/10.1089/109065700316525
43. An international classification of retinopathy of prematurity. The Committee for the Classification of Retinopathy of Prematurity. Arch Ophthalmol. 1984;102(8):1130-4. http://dx.doi.org/10.1001/archopht.123.7.991
44. An international classification of retinopathy of prematurity. II. The classification of retinal detachment. The International Committee for the Classification of the Late Stages of Retinopathy of Prematurity. Arch Ophthalmol. 1987;105(7):906-12. http://dx.doi.org/10.1001/archopht.1987.01060070042025
45. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol. 2005;123(7):991 -9. http://dx.doi.org/10.1001/archopht.123.7.991
46. Hutchinson AK, Saunders RA, O'Neil JW, Lovering A, Wilson ME. Timing of initial screening examinations for retinopathy of prematurity. Arch Ophthalmol. 1998; 116(5):608-12. http://dx.doi.org/10.1001/archopht.116.5.608
47. Azad R, Chandra P, Khan MA, Darswal A. Role of intravenous fluorescein angiography in early detection and regression of retinopathy of prematurity. J Pediatr Ophthalmol Strabismus. 2008;45(1):36-9. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A++++18286961
48. Ng EY, Lanigan B, O'Keefe M. Fundus fluorescein angiography in the screening for and management of retinopathy of prematurity. J Pediatr Ophthalmol Strabismus. 2006;43(2):85-90. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+16598974
49. Maidana EJ, Matieli LC, Allemann N, Melo Jr LA, Morales M, Moraes NS. Ultrasonographic findings in eyes with retinal detachments secondary to retinopathy of prematurity. J Pediatr Ophthalmol Strabismus. 2007;44(1):39-42. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+17274334
50. Tamburrelli C, Ricci B, Dicembrino M, Santo A. An ultrasonographic study of stage-5 retinopathy of prematurity. Ophthalmologica. 1998;212(6):381-8. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+9787227
51. Jokl DH, Silverman RH, Nemerofiky SL, Kane SA, Chiang MF, Lopez R, et al. Is there a role for high-frequency ultrasonography in clinical staging of retinopathy of prematurity? J Pediatr Ophthalmol Strabismus. 2006;43(1):31-5. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1618793/
52. Jokl DH, Silverman RH, Springer AD, Towers H, Kane S, Lopez R, et al. Comparison of ultrasonic and ophthalmoscopic evaluation of retinopathy of prematurity. J Pediatr Ophthalmol Strabismus. 2004;41(6):345-50. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2803061/?report=classic
53. ▲ Soares CR, Silveira RC, Procianoy RS. Ophthalmic artery blood flow in very-low-birth-weight preterm infants. Invest Ophthalmol Vis Sci. 2010;51(2):708-11. http://dx.doi.org/10.1167/iovs.09-4206
54. Neely D, Harris A, Hynes E, McNulty L, McCranor L, Siesky B, et al. Longitudinal assessment of plus disease in retinopathy of prematurity using color Doppler imaging. J AAPOS. 2009;13(5):509-11. http://dx.doi.org/10.1016/j.jaapos.2009.08.012
55. Baerts W, Wildervanck de Blécourt-Devilee M, Sauer PJ. Ambient light, ophthalmic artery blood flow velocities and retinopathy of prematurity. Acta Paediatr. 1993;82(9):719-22. http://dx.doi.org/10.1111/j.1651-2227.1993.tb1 2545.x
56. Romagnoli C, Papacci P, Zecca E, Giannantonio C, De Carolis MP, Tortorolo G. Normal neonatal values of ophthalmic and central retinal artery blood flow velocities. J Pediatr Ophthalmol Strabismus. 2001;38(4):213-7. Abstract disponível em: https://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11495308
57. Lago A, Matieli L, Gomes M, Baba NT, Farah ME, Belfort JR, et al. Stratus optical coherence tomography findings in patients with retinopathy of prematurity. Arq Bras Oftalmol. 2007;70(1):19-21. http://dx.doi.org/10.1590/S0004-27492007000100004
58. Joshi MM, Trese MT, Capone Jr A. Optical coherence tomography findings in stage 4A retinopathy of prematurity: a theory for visual variability. Ophthalmology. 2006;113(4):657-60. http://dx.doi.org/10.1016/j.ophtha.2006.01.007
59. Hutcheson KA, Paluru PC, Bernstein SL, Koh J, Rappaport EF, Leach RA, et al. Norrie disease gene sequence variants in an ethnically diverse population with retinopathy of prematurity. Mol Vis. 2005;11:501-8. Disponível em: http://www.molvis.org/molvis/v11/a58/
60. Multicenter trial of cryotherapy for retinopathy of prematurity. Preliminary results. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Arch Ophthalmol. 1988; 106(4):471-9. http://dx.doi.org/10.1001/archopht.1988.01060130517027
61. Fortes Filho JB, Eckert GU, Valiatti FB, Santos PGB, Costa MC, Procianoy RS. Postconceptional age at treatment of retinopathy of prematurity in inborn and referred preterm infants from the same institution. Arq Bras Oftalmol. 2011,74(4):251-4. http://dx.doi.org/10.1590/S0004-27492011000400004
62. Mintz-Hittner HA, Kennedy KA, Chuang AZ, BEAT-ROP Cooperative Group. Efficacy of intravitreal bevacizumab for stage 3+ retinopathy of prematurity. N Engl J Med. 2011;364:603. http://dx.doi.org/10.1056/NEJMoa1007374
63. Yetik H, Gunay M, Sirop S, Salihoglu Z. Intravitreal bevacizumab monotherapy for type-1 prethreshold, threshold, and aggressive posterior retinopathy of prematurity-27 month follow-up results from Turkey. Graefes Arch Clin Exp Ophthalmol. 2015;253:1677. http://dx.doi.org/10.1007/s00417-014-2867-0
64. Nicoara SD, Nascutzy C, Cristian C, Irimescu I, Stefanut AC, Zaharie G, et al. Outcomes and prognostic factors of intravitreal bevacizumab monotherapy in zone i stage 3+ and aggressive posterior retinopathy of prematurity. J Ophthalmol. 2015; 2015:102-582. http://dx.doi.org/10.1155/2015/102582
65. Hwang CK, Hubbard GB, Hutchinson AK, Lambert SR. Outcomes after intravitreal bevacizumab versus laser photocoagulation for retinopathy of prematurity: a 5-year retrospective analysis. Ophthalmology. 2015; 122:1008. http://dx.doi.org/10.1016/j.ophtha.2014.12.017.0
66. Arámbulo O, Dib G, Iturralde J, Duran F, Brito M, Fortes Filho JB. Intravitreal ranibizumab as a primary or a combined treatment for severe retinopathy of prematurity. Clin Ophthalmol. 2015;9:2027-32. http://dx.doi.org/10.2147/OPTH.S90979
67. Robinson R, O'Keefe M. Follow-up study on premature infants with and without retinopathy of prematurity. Br J Ophthalmol. 1993;77(2):91-4. http://dx.doi.org/10.1136/bjo.77.2.91
68. McNamara JA, Tasman W, Brown GC, Federman JL. Laser photocoagulation for stage 3+ retinopathy of prematurity. Ophthalmology. 1991;98(5):576-80. http://dx.doi.org/10.1016/S0161-6420(91)32247-4
69. Good WV. Final results of the Early Treatment for Retinopathy of Prematurity (ETROP) randomized trial. Trans Am Ophthalmol Soc. 2004;102:233-50. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1280104/
70. Good WV. The early treatment for retinopathy of prematurity study: structural findings at age 2 years. Br J Ophthalmol. 2006;90(11):1378-82. http://dx.doi.org/10.1136/bjo.2006.098582
71. Holmstrom G, el Azazi M, Kugelberg U. Ophthalmological follow up of preterm infants: a population based, prospective study of visual acuity and strabismus. Br J Ophthalmol. 1999;83(2):143-50. http://dx.doi.org/10.1136/bjo.83.2.143


Fonte de financiamento: declaro não haver.
Conflito de interesses: declaro não haver.
Recebido em:
14 de Novembro de 2016.
Aceito em:
24 de Novembro de 2016.