Carlos Augusto Moreira Neto; Gilberto Antonio Tesser Augusto
DOI: 10.17545/eOftalmo/2021.0014
RESUMO
A Oclusão da Veia Central da Retina é o bloqueio da circulação sanguínea retiniana por obstrução da veia central da retina. Subdivide-se em isquêmica e não isquêmica de acordo com o grau de oclusão e de isquemia retiniana. O evento obstrutivo proporciona o desenvolvimento de alterações vasculares importantes, aumento de fatores inflamatórios e edema retiniano. O diagnóstico é feito pelos achados oftalmoscópicos e exames complementares. A apresentação clínica é variável, desde perda visual unilateral indolor insidiosa até perda abrupta e profunda da visão. Glaucoma neovascular é a complicação mais severa. A complicação mais comum é o edema macular. O tratamento inclui identificação e correção dos fatores de risco vasculares sistêmicos. O uso de injeções intravítreas de antiangiogênicos e corticoides pode auxiliar na melhora da acuidade visual final. Neste artigo de revisão descreveremos os principais aspectos clínicos e terapêuticos da oclusão venosa central retiniana.
Palavras-chave: Veia central da retina; Oclusão da veia retiniana; VEGF; Injeções intravítreas; Edema macular.
ABSTRACT
Central retinal vein occlusion is the blockage of retinal blood circulation owing to obstruction of the central retinal vein. Depending to the degree of occlusion and retinal ischemia, it is classified into ischemic and non-ischemic forms. Central retinal vein occlusion leads to the development of important vascular alterations, increased inflammatory factors, and retinal edema. Diagnosis is made by ophthalmoscopy findings and complementary examinations. The clinical presentation varies from insidious painless unilateral vision loss to abrupt and profound vision loss. Neovascular glaucoma is the most severe complication, and macular edema is the most common complication. Treatment includes the identification and correction of systemic vascular risk factors. Intravitreal injections of antiangiogenics and corticosteroids can help improve final visual acuity. In this review article, we describe the main clinical and therapeutic aspects of central retinal vein occlusion.
Keywords: Central retinal vein; Retinal vein occlusion; VEGF; Intravitreal injections; Macular edema.
INTRODUÇÃO
A oclusão da veia central da retina (OVCR) ocorre por bloqueio da circulação sanguínea retiniana por obstrução da veia central da retina e, consequentemente, dos seus ramos, na região da lâmina crivosa ou logo posteriormente a ela1.
A oclusão venosa retiniana (OVR) representa a segunda maior causa de cegueira vascular, superada apenas pela retinopatia diabética. Em 2008, estimava-se que aproximadamente 16,4 milhões de adultos eram portadores de algum tipo de OVR, sendo que 2,5 milhões eram atingidos pela OVCR2.
A prevalência mundial de OVCR é de aproximadamente de 0,08%, com distribuição semelhante entre etnias, gêneros e com aumento do risco ao envelhecimento 2. Entretanto, um estudo relatou que negros teriam 58% mais chances de desenvolver OVCR do que brancos3.
O maior preditor do desenvolvimento de OVR é a presença de episódio prévio no olho contralateral. O risco de acometimento contralateral nos indivíduos com OVCR é de aproximadamente 1% ao ano4.
Fatores de risco cardiovasculares tais como aterosclerose, hipertensão arterial e diabetes estão comumente associados a todos os tipos de OVR, entretanto as oclusões de veia também podem ser secundárias a outros processos, como inflamação, vasoespasmo ou compressão5.
A OVCR está relacionada com glaucoma, apneia do sono, trombofilias e homocistinúria6. Outro estudo demonstra maior risco de OVR relacionado ao tabagismo, alcoolismo, hipermetropia e pseudofacia7.
A hiperviscosidade sanguínea presente em transtornos mieloproliferativos pode se associar a OVCR. Entidades inflamatórias causadoras de vasculite sistêmica (Behçet, lúpus, poliarterite nodosa) e estados de hipercoagulação (hiperhomocisteinemia, síndrome antifosfolipide, deficiência proteína C, S e antitrombina III) apesar de raras foram descritas como fatores de risco para OVR, principalmente em pacientes jovens8,9.
A incidência de OVCR aumenta com a idade, sendo que a maioria dos indivíduos afetados possuem 50 anos de idade ou mais10. OVCR em adultos jovens é incomum e somente 10-15% dos pacientes possuem menos de 40 anos de idade11.
MÉTODOS
Trata-se de uma revisão narrativa de literatura desenvolvida a partir de base de dados eletrônica (PUBMED/MEDLINE, Google Scholar, SCIELO), utilizando as palavras veia central da retina, oclusão venosa retiniana, VEGF e edema macular. Os termos foram utilizados em português e inglês, de forma individual e em combinações. Os autores selecionaram os artigos considerados mais importantes e suas informações foram extraídas para compor a base textual e descrever os aspectos mais relevantes da oclusão venosa central da retina.
Fisiopatologia
A patogênese da OVCR é multifatorial, por alterações de fatores hematológicos, compressão e anormalidades na parede dos vasos. A existência de uma íntima relação anatômica na região posterior à lâmina crivosa entre a camada íntima da artéria e veia centrais da retina podem levar a uma compressão venosa e formação de trombo de fibrina e plaquetas com consequente obstrução do vaso12 .
A OVR pode causar apoptose celular endotelial aguda, danos aos pericitos e aumento de permeabilidade vascular. Como efeito final de um turnover anormal de células endoteliais e hipersensibilidade retiniana a hipóxia, tornam-se presentes a isquemia crônica e o edema13.
O aumento da pressão intraluminal, como consequência do evento obstrutivo, dispara a produção de mediadores inflamatórios, incluindo o fator de crescimento vascular endotelial (VEGF) e compromete a barreira hematorretiniana interna. Esse fato promove transudação dos vasos com consequente edema do nervo óptico, hemorragias intrarretinianas nos quatro quadrantes retinianos e edema macular. Quando ocorre, a presença de neovascularização pode resultar em glaucoma neovascular e hemorragia vítrea14,15.
Classificação
A OVCR consiste em duas distintas entidades – tipo isquêmico e não isquêmico. Cerca de 80% dos pacientes pertencem a OVCR não isquêmica que é caracterizada por uma retinopatia de estase venosa e por uma obstrução posterior (ou) retrolaminar, fato que poderia justificar uma retinopatia mais branda devido à presença de maior número de canais venosos colaterais. Na OVCR isquêmica, com características de uma retinopatia hemorrágica, existe a obstrução venosa ao nível da lâmina crivosa ou imediatamente posterior a ela. Poucos colaterais venosos estão presentes para auxiliar a drenagem e a retina sofre com extensa isquemia por redução da pressão de perfusão. Sabe-se ainda que a forma não isquêmica, em alguns casos, pode progredir para isquêmica provavelmente por redução da perfusão retiniana durante o sono ou por migração do trombo para região mais próxima da lâmina crivosa16.
A classificação de subtipos de OVCR é baseada nos achados da Angiografia Fluoresceínica (AF). A OVCR não-isquêmica é caracterizada por uma área de isquemia inferior a 10 áreas de disco e ausência de neovascularização retiniana ao exame. O tipo isquêmico é caracterizado por neovascularização retiniana ou de íris com grande área de isquemia (maior que 10 áreas de disco) e maior número de hemorragias4.
Essa classificação foi útil para uso em estudos, entretanto com o advento da angiografia de grande angular é possível avaliar de forma mais completa as grandes áreas periféricas de não perfusão nos casos de OVCR17. Sugere-se que índices de isquemia periférica maiores do que 35% são um critério angiográfico para classificação da OVCR como subtipo isquêmico18.
Sinais e sintomas
Os pacientes com OVCR devem ser submetidos a um exame ocular completo. Sintomas oculares na abertura do quadro de OVCR são variáveis, desde pacientes assintomáticos até baixa importante da acuidade visual (AV). A perda visual costuma ser súbita e unilateral, entretanto pode apresentar-se como gradual, posteriormente evoluindo para definitiva, em um período de dias a semanas19.
O examinador deve determinar qual o subtipo de apresentação de OVCR está a se desenvolver. A forma não isquêmica é a apresentação clínica mais comum, o paciente refere turvação visual unilateral e súbita, com prejuízo moderado da AV (20/200, ou melhor). A fundoscopia apresenta os ramos da veia central da retina tortuosos e dilatados, acompanhados de hemorragias em “chama de vela” em todos os quadrantes, mais pronunciadas na periferia20 (Figura 1A).
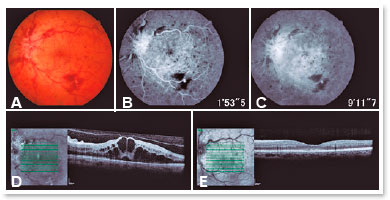
Quase todos os pacientes com a OVCR isquêmica apresentam a AV inicial de 20/200 ou pior e aproximadamente metade têm acometimento significante do campo visual periférico. A maior parte também exibe um defeito pupilar relativo aferente, que pode ser um indicador sensível e específico para a forma isquêmica6.
A fundoscopia da forma isquêmica é mais proeminente, reconhecida por grande ingurgitamento e tortuosidade dos ramos da veia central da retina, além de exsudatos algodonosos associados a hemorragias extensas. A presença de exsudatos algodonosos reflete infartos focais da camada de fibras nervosas e neovascularização de segmento anterior ou posterior em estágios mais avançados21.
A congestão dos capilares pode resultar em edema macular e do nervo óptico. Dessa maneira uma queixa que pode estar presente é a metamorfopsia associada ao rebaixamento da AV6.
Exames complementares
A avaliação de pacientes com OVR deve incluir uma anamnese ampla e investigação laboratorial para identificação de fatores de risco cardiovasculares. Exames sugeridos incluem a realização de: eletrocardiograma, hemograma completo, velocidade de hemossedimentação, ureia, eletrólitos, creatinina, glicemia, lipidograma, eletroforese de proteínas, função tireoidiana e pressão arterial22.
Nos últimos anos, discute-se a hipótese de que distúrbios da coagulação estariam relacionados à OVR23. Testes para distúrbios de coagulação podem ser realizados em casos selecionados, tais como: pacientes jovens (<50 anos), oclusão venosa bilateral, histórico de distúrbios de coagulação ou trombofilias22. No caso das trombofilias, um estudo sugere que a investigação deve focar a deficiência de fator XII, Fator V de Leiden, homocisteinemia, anticorpo antifosfolipide e deficiência de proteínas anticoagulantes C e S24.
Exames de imagem oftalmológicos
As investigações oculares para OVCR costumam incluir a AF e a Tomografia de Coerência Óptica - OCT – Optical Coherence Tomography e mais recentemente a Angiografia por Tomografia de Coerência Óptica (OCTA).
Angiografia Fluoresceínica (AF)
A AF é uma ferramenta útil e objetiva para o estudo da circulação retiniana através do uso de contraste de fluoresceína endovenoso. A fluoresceína extravasa somente de vasos e capilares fisiologicamente anormais e a quantidade de extravasamento depende da gravidade da oclusão25.
Em quadros de OVCR, a AF permite a análise da má perfusão capilar periférica, da isquemia macular e uma detecção de neovascularização, inclusive distinguindo-a da formação de circulação colateral6.
Em quadros de OVCR, a AF demonstra enchimento normal da coroide, entretanto pode-se ter um atraso variável no enchimento vascular retiniano causado por congestão do fluxo venoso. As fases tardias da AF apresentam um padrão variável de impregnação da cabeça nervo óptico e das veias retinianas, associadas a graus variáveis de má perfusão capilar e extravasamento na região macular1 (Figura 1B e 1C).
A AF é útil para fornecer informações sobre o leito capilar da retina (permeabilidade ou não perfusão) e na diferenciação de OVR tipo isquêmico e não-isquêmico. Outros achados incluem o extravasamento tardio na área macular e no preenchimento das veias. O edema macular geralmente se apresenta como uma hiperfluorescência em cavidades císticas radiais, formando um padrão “petaloide”. A presença de não perfusão periférica é característica das OVR isquêmicas e consiste em um fator de risco importante para a neovascularização. A não perfusão macular está correlacionada com um mau prognóstico visual que pode dificultar a melhora de AV, mesmo com os tratamentos para EM26.
Tomografia de Coerência Óptica (OCT)
A OCT é um método de investigação não invasivo da retina que através de imagens seccionais permite identificar as camadas da retina em detalhes quase histológicos27. É um exame importante para confirmar e acompanhar a presença de edema macular6.
Nos quadros de OVCR, a OCT geralmente mostrará cistos intrarretinianos (Figura 1D) com espessamento retiniano e ocasionalmente associação com fluído submacular. Quanto a alterações estruturais, pode estar presente a perda da relação entre segmentos internos e externos dos fotorreceptores e a distorção da arquitetura das camadas nucleares e plexiformes internas1,27.
Angiografia por Tomografia de Coerência Óptica (OCTA)
A Angiografia Tomografia de Coerência Óptica (OCTA) é uma técnica de imagem recente, não invasiva, que foi desenvolvida para permitir o estudo de microvasculatura retiniana sem injeção de contraste. O movimento das hemácias dentro dos capilares retinianos é usado como meio de contraste intrínseco para gerar imagens de fluxo. A OCTA fornece imagens da rede capilar da retina superficial e profunda com visualização detalhada da zona avascular da fóvea (ZAF) e possibilidade da construção de um mapa vascular da circulação retiniana em 3 dimensões28.
A OCTA demonstra os achados característicos das oclusões venosas na AF, tais como a diminuição da perfusão capilar, edema macular, dilatação vascular, ampliação da ZAF e formação de circulação venosa colateral29.
Acompanhamento e prognóstico
O acompanhamento oftalmológico deve prevenir e identificar complicações provocadas pela isquemia retiniana tais como glaucoma neovascular, hemorragia vítrea e edema macular.
Em quadros isquêmicos, o acompanhamento deve ser mensal no primeiro semestre, para monitoramento do edema macular e busca por indícios de neovascularização do segmento anterior. O acompanhamento de olhos com isquemia significante após o primeiro semestre, deve ser feito a cada 3 meses por um ano. Em casos não isquêmicos, sugere-se um acompanhamento trimestral nos primeiros 6 meses. O acompanhamento subsequente para todos os pacientes é dependente do tratamento realizado e das complicações apresentadas, mas em casos não complicados normalmente não será necessário após 2 anos. O edema macular pode recorrer por vários anos, logo um acompanhamento além das recomendações pode ser necessário para manutenção da AV a longo prazo30.
A AV inicial costuma ser o fator mais confiável para predizer gravidade e o prognostico visual em olhos com OVCR27.
No caso de pacientes com AV 20/60, ou melhor, a tendência é a permanência da visão; AV entre 20/80 e 20/200 apresentam curso clínico variável e pior que 20/200 a melhora da AV não é esperada4.
O prognóstico da OVCR isquêmica é pobre, devido à presença de isquemia macular e maior risco de neovascularização. Em um estudo verificou-se uma incidência acumulativa aos 9 meses pós OVCR isquêmica de 52% e 34% de neovascularização e desenvolvimento de glaucoma neovascular, respectivamente31.
A conversão da forma não isquêmica para o tipo isquêmico geralmente ocorre em um terço dos pacientes dentro de 3 anos32.
Os principais fatores relacionados ao desenvolvimento de glaucoma neovascular são: histórico de hipertensão arterial, baixa AV ou DPRA na abertura do quadro. Em caso de piora da AV ou do surgimento de DPRA a conversão para isquemia deve ser considerada e o paciente submetido a um acompanhamento mais próximo33.
TRATAMENTO
As intervenções realizadas nos quadros de OVCR têm como foco as sequelas da oclusão, que incluem o edema macular e a isquemia retiniana1.
As opções atuais de tratamento incluem o uso de laser, intervenções cirúrgicas e injeções intravítreas de corticosteroides e inibidores do VEGF34.
Até o momento não existem evidências consistentes de que tratamentos clínicos alterem favoravelmente a evolução natural da OVCR. Não há comprovação de que o uso de antiagregantes plaquetários, anticoagulantes, agentes trombolíticos ou hemodiluição sejam efetivos na melhora da AV35.
O uso de agentes antiplaquetários ou anticoagulantes sistêmicos para o tratamento de OVCR não demonstra benefícios e foi associado a um pior desfecho da acuidade visual final, maior perda de campo visual e piora das hemorragias retinianas36.
A otimização do controle de hipertensão arterial, diabetes, dislipidemia e PIO são importantes para o controle de fatores de risco sistêmicos para OVCR e outras consequências de danos em órgãos alvo37.
A maioria dos procedimentos cirúrgicos necessita de maiores estudos e não deve ser indicada de forma rotineira devido a possíveis complicações. O uso de trombolíticos por injeção na artéria oftálmica ainda não demonstrou eficácia clara. Outras técnicas cirúrgicas, como peeling de membrana limitante interna, neurotomia radial e descompressão da bainha do nervo óptico não se demonstram totalmente eficazes35.
A formação de anastomoses coriorretinianas por laser possui resultados variáveis (33 a 88% de sucesso na melhora da AV), mas permanece como uma terapia experimental38.
O desenvolvimento de hemorragia vítrea importante ou descolamento de retina tracional pode ser controlado com técnicas de vitrectomia39.
Edema macular e neovascularização
O edema macular, causado por extravasamento de fluido capilar na área macular central, é a causa mais comum de perda visual em pacientes com OVR40.
Na OVCR não isquêmica, ao longo do tempo, demonstrou-se autorresolução do edema macular em cerca de 30% dos olhos41.
O uso isolado de laser em grid macular não demonstrou grande benefício na melhora da AV ainda que reduza significativamente o extravasamento na angiografia42.
Entretanto, estudos demonstram efeitos benéficos no uso combinado de laser e injeções intravítreas na melhora da AV em casos de OVR, além de melhor resposta terapêutica e com menos intervenções43.
O uso de grid macular poderia ser considerado em pacientes com edema macular persistente após 3 a 4 injeções mensais de anti-VEGF, guiado por AF, para determinação dos locais de isquemia e extravasamento que poderiam se beneficiar do tratamento com laser44.
Adicionalmente, não é mais recomendada realização profilática de panfotocoagulação retiniana na OVCR isquêmica, pois não previne a neovascularização da íris. Entretanto, a fotocoagulação a laser deve ser feita quando a neovascularização é manifesta no segmento anterior, disco ou retina8.
Quando o seguimento regular é impraticável, panfotocoagulação profilática pode ser aconselhável30.
O uso de anti-VEGF intravitreo ou intracameral pode auxiliar de forma expressiva na regressão da neovascularização retiniana e do segmento anterior45.
Em caso de glaucoma neovascular estabelecido e com olho cego, o objetivo deve ser o controle da dor com o uso de esteroides tópicos e atropina. Entretanto, caso exista prognóstico visual, deve-se buscar controle de pressão intraocular com colírios hipotensores ou cirurgia40.
Recentemente foram comprovados benefícios efetivos no manejo do edema macular através do uso de injeções intravítreas de Anti-VEGF (bevacizumabe, ranibizumabe, aflibercepte) e de corticoides (triancinolona, dexametasona). Ambas as classes apresentam mecanismos antinflamatórios e antiproliferativos importantes que auxiliam na redução do edema macular, neovascularização e melhora da AV46.
Agentes anti-vegf
Existem três agentes anti-VEGF que estão disponíveis para uso: bevacizumabe (off-label), ranibizumabe e aflibercepte. Atualmente, a terapia intravítrea com agentes anti-VEGF é considerada terapia de primeira linha para o tratamento de EM associado à OVR47.
Em olhos com OVR, as alterações estruturais no sistema venoso da retina levam a um reduzido fluxo sanguíneo, níveis variáveis de hipóxia e um subsequente aumento acentuado nos níveis intravítreos de VEGF48,49.
Os níveis de VEGF intravítreo mostraram correlacionar-se com a gravidade dos achados clínicos50.
Ranibizumabe
Ranibizumabe é um anticorpo monoclonal humanizado recombinante com capacidade de inibir a atividade biológica de todos os tipos de VEGF-A. Foi desenvolvido especificamente para uso intravítreo e é aprovado para o tratamento de EM relacionado à OVR51.
Nos estudos CRUISE e BRAVO, as injeções mensais de 0,5 mg de ranibizumabe melhoraram significativamente a função visual (respectivamente, 18,3 e 14,9 letras ETDRS vs. 7,3 e 0,8 letras no grupo controle) além de melhora na espessura foveal central média (345 µm e 442 µm vs. 158 µm e 168 µm no grupo controle) em pacientes com OVR após 6 meses de acompanhamento51,47.
Embora a resolução do EM ocorra em cerca de metade dos pacientes com OVR com o uso de ranibizumabe, nos casos de OVCR, um número substancial de indivíduos necessita de injeções frequentes, mesmo anos após o tratamento inicial52.
Aflibercepte
O Aflibercepte é uma proteína de fusão nos domínios dos receptores de VEGF humanos 1 e 2 com uma fração de IgG humana. É capaz de bloquear as todas as isoformas de VEGF-A. Apresenta uma longa duração e maior afinidade por VEGF-B e o fator de crescimento placentário53.
Dois ensaios clínicos randomizados (GALILEO E COPERNICUS) avaliaram o uso de aflibercepte intravítreo versus injeções simuladas para o tratamento de EM secundário a OVCR, com resultados semelhantes. Ambos os estudos demonstraram a eficácia do aflibercepte na melhora dos resultados anatômicos e visuais de pacientes com OVCR com EM nos primeiros 6 meses sob administração mensal fixa de aflibercepte54,55. No estudo GALILEO, respectivamente 60,2% e 22,1% dos doentes em tratamento e placebo apresentaram um ganho de pelo menos 15 letras após 6 meses de tratamento54.
No estudo COPERNICUS, houve o ganho de 15 letras em 56% dos olhos tratados comparados a 12% do tratamento simulado após 6 meses de tratamento. Também não houve casos com neovascularização ou fotocoagulação no grupo com aflibercepte. Além disso, esses estudos ajudaram a mostrar os benefícios do tratamento em comparação com a história natural, mas também os resultados superiores com o tratamento precoce do EM relacionado à OVCR com o aflibercepte55.
Bevacizumabe
É um anticorpo humanizado que bloqueia todos os subtipos de VEGF-A. Diversos estudos demonstraram que a aplicação intravítrea de bevacizumabe aumentou a acuidade visual concomitantemente a uma redução da espessura macular central56-58.
Um grande estudo retrospectivo multicêntrico incluiu o tratamento de 44 olhos recebendo 1.25 mg de bevacizumabe a cada 4-8 semanas durante dois anos de seguimento para qualquer sinal de edema macular. Demonstrou-se um ganho médio de 3,5 linhas ETDRS em 24 meses e a espessura macular central reduziu de 635 μm basais para 364 μm ao final do estudo59.
Até o momento não há aprovação do bevacizumabe pelo FDA para uso intraocular, devido à falta de grandes ensaios clínicos randomizados e seu uso se mantém off-label60.
Corticoides
Os agentes corticosteroides são capazes de reduzir edema por estabilizarem a permeabilidade vascular, reduzir mediadores inflamatórios e de forma indireta bloquear as ações do VEGF46.
Atualmente duas medicações deste grupo são utilizadas para o tratamento de EM associado à OVCR: implante intravítreo de dexametasona (on-label) e triancinolona (uso off-label)61,62.
Os esteroides (triancinolona e dexametasona) estão associados a aumentos clinicamente significativos na pressão intraocular (PIO) e na progressão da catarata. A triancinolona é um tratamento com boa relação custo-benefício em grupos selecionados de pacientes, como indivíduos pseudofácicos ou aqueles com catarata preexistente que podem exigir cirurgia de catarata em breve46.
O estudo SCORE-CRVO procurou avaliar a melhora do EM associado a OVCR após aplicação intraocular de triancinolona em doses de 1mg e 4mg em comparação a um grupo controle. Observou-se ganho de 15 ou mais letras ETDRS em 26,5% dos pacientes submetidos à aplicação de 4mg de triancinolona após 12 meses de acompanhamento, e diminuição da espessura macular central em relação ao valor basal foi maior neste grupo. Entretanto, a proporção de pacientes com 250 μm ou menos de espessura macular central foi semelhante nos três grupos no final de 12 meses63.
O estudo GENEVA avaliou o uso do implante de dexametasona (Ozurdex®) para o tratamento de EM secundário a ORVCR e OVCR. O estudo demonstrou efetividade a longo termo e melhora significativa da acuidade visual nos grupos com uso da medicação (0.35 mg e 0.70 mg) em comparação ao controle64.
REFERÊNCIAS
1. McAllister IL. Central retinal vein occlusion: a review. Clin Exp Ophthalmol. 2012;40(1):48-58.
2. Rogers S, McIntosh RL, Cheung N, Lim L, Wang JJ, Mitchell P, et al. The prevalence of retinal vein occlusion: pooled data from population studies from the United States, Europe, Asia, and Australia. Ophthalmology. 2010;117(2):313-9.
3. Stem MS, Talwar N, Comer GM, Stein JD. A longitudinal analysis of risk factors associated with central retinal vein occlusion. Ophthalmology. 2013;120(2):362-70.
4. The Central Vein Occlusion Study Group. Natural history and clinical management of central retinal vein occlusion. Arch Ophthalmol. 1997;115(4):486-91.
5. O’Mahoney PRA, Wong DT, Ray JG. Retinal Vein Occlusion and Traditional Risk Factors for Atherosclerosis. JAMA Ophthalmol. 2008;126(5):692-9.
6. Ip M, Hendrick A. Retinal Vein Occlusion Review. Asia Pac J Ophthalmol. 2018;7(1):40-5.
7. Thapa R, Bajimaya S, Paudyal G, Khanal S, Tan S, Thapa SS, et al. Prevalence, pattern and risk factors of retinal vein occlusion in an elderly population in Nepal: the Bhaktapur retina study. BMC Ophthalmol. 2017;17(1):162.
8. Karia N. Retinal vein occlusion: pathophysiology and treatment options. Clin Ophthalmol. 2010;4:809-16.
9. Wittström E. Central Retinal Vein Occlusion in Younger Swedish Adults: Case Reports and Review of the Literature. Open Ophthalmol J. 2017;11:89-102.
10. Mitchell P, Smith W, Chang A. Prevalence and Associations of Retinal Vein Occlusion in Australia: The Blue Mountains Eye Study. JAMA Ophthalmol. 1996;114(10):1243-7.
11. Marcucci R, Sofi F, Grifoni E, Sodi A, Prisco D. Retinal vein occlusions: a review for the internist. Intern Emerg Med. 2011;6(4):307-14.
12. Green WR, Chan CC, Hutchins GM, Terry JM. Central retinal vein occlusion: a prospective histopathologic study of 29 eyes in 28 cases. Trans Am Ophthalmol Soc. 1981;79:371-422.
13. Li J, Paulus YM, Shuai Y, Fang W, Liu Q, Yuan S. New Developments in the Classification, Pathogenesis, Risk Factors, Natural History, and Treatment of Branch Retinal Vein Occlusion. J Ophthalmol. 2017;2017:4936924.
14. Sauder G, Jonas JB. Ophthalmodynamometric Assessment of the Central Retinal Vein Collapse Pressure in Eyes with Retinal Vein Stasis or Occlusion. Invest Ophthalmol Vis Sci. 2003;44(13):352.
15. Noma H, Mimura T, Eguchi S. Association of Inflammatory Factors with Macular Edema in Branch Retinal Vein Occlusion. JAMA Ophthalmol. 2013;131(2):160-5.
16. Hayreh S. Retinal vein occlusion. Indian J Ophthalmol. 1994;42(3): 109-32.
17. Spaide RF. Peripheral areas of nonperfusion in treated central retinal vein occlusion as imaged by wide-field fluorescein angiography. Retina. 2011;31(5):829-37.
18. Thomas AS, Thomas MK, Finn AP, Fekrat S. Use of the ischemic index on widefield fluorescein angiography to characterize a central retinal vein occlusion as ischemic or nonischemic. Retina. 2019;39(6):1033-8.
19. Kooragayala LM, Pakaini V, Fong D, Charles S, Brown L, Roy Sr H. Central retinal vein occlusion. Disponível em: http://emedicinemedscape com/article/1223746-overview. 2005.
20. Hayreh S. Classification of Central Retinal Vein Occlusion. Ophthalmology. 1983;90(5):458-74.
21. Ehlers JP, Fekrat S. Retinal Vein Occlusion: Beyond the Acute Event. Surv. Ophthalmol. 2011;56(4):281-99.
22. Wong TY, Scott IU. Retinal-Vein Occlusion. N Engl J Med 2010; 363(22):2135-44.
23. Rehak M, Rehak J, Müller M, Faude S, Faude F, Siegemund A, et al. The prevalence of activated protein C (APC) resistance and factor V Leiden is significantly higher in patients with retinal vein occlusion without general risk factors. Thromb Haemost. 2008;99(11):925-9.
24. Kuhli-Hattenbach C, Scharrer I, Lüchtenberg M, Hattenbach L-O. Coagulation disorders and the risk of retinal vein occlusion. Thromb Haemost. 2010;103(02):299-305.
25. Kolar P. Definition and classification of retinal vein occlusion. Int J Ophthalmol Res. 2016;2(2):124-9.
26. Ho M, Liu DTL, Lam DSC, Jonas JB. Retinal vein occlusions, from basics to the latest treatment. Retina. 2016;36(3):432-48.
27. Lima VC, Yeung L, Castro LC, Landa G, Rosen RB. Correlation between spectral domain optical coherence tomography findings and visual outcomes in central retinal vein occlusion. Clin Ophthalmol. 2011;5:299-305.
28. Cardoso JN, Keane PA, Sim DA, Bradley P, Agrawal R, Addison PK, et al. Systematic Evaluation of Optical Coherence Tomography Angiography in Retinal Vein Occlusion. Am J Ophthalmol. 2016;163:93-107.
29. Mastropasqua R, Toto L, Di Antonio L, Borrelli E, Senatore A, Di Nicola M, et al. Optical coherence tomography angiography microvascular findings in macular edema due to central and branch retinal vein occlusions. Sci. Rep. 2017;7:40763.
30. Sivaprasad S, Amoaku WM, Hykin P, Sivaprasad S, Amoaku W, Williamson T, et al. The Royal College of Ophthalmologists Guidelines on retinal vein occlusions: executive summary. Eye. 2015;29(12):1633-8.
31. Hayreh SS, Zimmerman MB. Ocular neovascularization associated with central and hemicentral retinal vein occlusion. Retina. 2012;32(8):1553-65.
32. The Central Vein Occlusion Study Group. Baseline and Early Natural History Report: The Central Vein Occlusion Study. JAMA Ophthalmol. 1993;111(8):1087-95.
33. Rong AJ, Swaminathan SS, Vanner EA, Parrish RK. Predictors of Neovascular Glaucoma in Central Retinal Vein Occlusion. Am J Ophthalmol. 2019;204:62-9.
34. Bradshaw SE, Gala S, Nanavaty M, Shah A, Mwamburi M, Kefalas P. Systematic literature review of treatments for management of complications of ischemic central retinal vein occlusion. BMC Ophthalmol. 2016;16(1):104.
35. Mohamed Q, McIntosh RL, Saw SM, Wong TY. Interventions for Central Retinal Vein Occlusion: An Evidence-Based Systematic Review. Ophthalmology. 2007;114(3):507-19.
36. Hayreh SS, Podhajsky PA, Zimmerman MB. Central and Hemicentral Retinal Vein Occlusion: Role of Anti–Platelet Aggregation Agents and Anticoagulants. Ophthalmology. 2011; 118(8):1603-11.
37. Pulido JS, Flaxel CJ, Adelman RA, Hyman L, Folk JC, Olsen TW. Retinal vein occlusions preferred practice pattern® guidelines. Ophthalmology. 2016;123(1):P182-P208.
38. McAllister IL, Smithies LA, Previn V. Technique of laser chorioretinal anastomosis creation in central retinal vein occlusion and success rate with a new photocoagulator system. Retina. 2016;36(10):1971-8.
39. Bhagat N, Goldberg MF, Gascon P, Bell W, Haberman J, Zarbin MA. Central Retinal Vein Occlusion: Review of Management. Eur J Ophthalmol. 1999;9(3):165-80.
40. Kiire CA, Chong NV. Managing retinal vein occlusion. BMJ. 2012;344:e499.
41. McIntosh RL, Rogers SL, Lim L, Cheung N, Wang JJ, Mitchell P, et al. Natural History of Central Retinal Vein Occlusion: An Evidence-Based Systematic Review. Ophthalmology. 2010;117(6):1113-23.
42. The Central Vein Occlusion Study Group. Evaluation of Grid Pattern Photocoagulation for Macular Edema in Central Vein Occlusion: The Central Vein Occlusion Study Group M Report. Ophthalmology. 1995;102(10):1425-33.
43. Shah NJ, Shah UN. Long-term effect of early intervention with single intravitreal injection of bevacizumab followed by panretinal and macular grid photocoagulation in central retinal vein occlusion (CRVO) with macular edema: A pilot study. Eye. 2011;25(2):239-44.
44. Berger AR, Cruess AF, Altomare F, Chaudhary V, Colleaux K, Greve M, et al. Optimal Treatment of Retinal Vein Occlusion: Canadian Expert Consensus. Ophthalmologica. 2015;234(1):6-25.
45. Chalam KV, Gupta SK, Grover S, Brar VS, Agarwal S. Intracameral Avastin Dramatically Resolves Iris Neovascularization and Reverses Neovascular Glaucoma. Eur J Ophthalmol. 2008;18(2):255-62.
46. Ford JA, Clar C, Lois N, Barton S, Thomas S, Court R, et al. Treatments for macular oedema following central retinal vein occlusion: systematic review. BMJ Open. 2014;4(2):e004120.
47. Brown DM, Campochiaro PA, Singh RP, Li Z, Gray S, Saroj N, et al. Ranibizumab for Macular Edema following Central Retinal Vein Occlusion: Six-Month Primary End Point Results of a Phase III Study. Ophthalmology. 2010;117(6):1124-33.
48. Funk M, Kriechbaum K, Prager F, Benesch T, Georgopoulos M, Zlabinger GJ, et al. Intraocular Concentrations of Growth Factors and Cytokines in Retinal Vein Occlusion and the Effect of Therapy with Bevacizumab. Invest Ophthalmol Vis Sci. 2009;50(3):1025-32.
49. Noma H, Funatsu H, Yamasaki M, Tsukamoto H, Mimura T, Sone T, et al. Aqueous humour levels of cytokines are correlated to vitreous levels and severity of macular oedema in branch retinal vein occlusion. Eye. 2008;22(1):42-8.
50. Boyd SR, Zachary I, Chakravarthy U, Allen GJ, Wisdom GB, Cree IA, et al. Correlation of Increased Vascular Endothelial Growth Factor With Neovascularization and Permeability in Ischemic Central Vein Occlusion. JAMA Ophthalmol. 2002;120(12):1644-50.
51. Campochiaro PA, Heier JS, Feiner L, Gray S, Saroj N, Rundle AC, et al. Ranibizumab for Macular Edema following Branch Retinal Vein Occlusion: Six-Month Primary End Point Results of a Phase III Study. Ophthalmology. 2010;117(6):1102-12.
52. Campochiaro PA, Sophie R, Pearlman J, Brown DM, Boyer DS, Heier JS, et al. Long-term Outcomes in Patients with Retinal Vein Occlusion Treated with Ranibizumab: The RETAIN Study. Ophthalmology. 2014;121(1):209-19.
53. Holash J, Davis S, Papadopoulos N, Croll SD, Ho L, Russell M, et al. VEGF-Trap: A VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A. 2002;99(17):11393.
54. Korobelnik J-F, Holz FG, Roider J, Ogura Y, Simader C, Schmidt-Erfurth U, et al. Intravitreal Aflibercept Injection for Macular Edema Resulting from Central Retinal Vein Occlusion: One-Year Results of the Phase 3 GALILEO Study. Ophthalmology. 2014;121(1):202-8.
55. Heier JS, Clark WL, Boyer DS, Brown DM, Vitti R, Berliner AJ, et al. Intravitreal Aflibercept Injection for Macular Edema Due to Central Retinal Vein Occlusion: Two-Year Results from the COPERNICUS Study. Ophthalmology. 2014;121(7):1414-20.
56. Epstein DL, Algvere PV, von Wendt G, Seregard S, Kvanta A. Bevacizumab for Macular Edema in Central Retinal Vein Occlusion: A Prospective, Randomized, Double-Masked Clinical Study. Ophthalmology. 2012;119(6):1184-9.
57. Epstein DL, Algvere PV, von Wendt G, Seregard S, Kvanta A. Benefit from Bevacizumab for Macular Edema in Central Retinal Vein Occlusion: Twelve-Month Results of a Prospective, Randomized Study. Ophthalmology. 2012;119(12):2587-91.
58. Zhang H, Liu Z-L, Sun P, Gu F. Intravitreal Bevacizumab for Treatment of Macular Edema Secondary to Central Retinal Vein Occlusion: Eighteen-Month Results of a Prospective Trial. J Ocul Pharmacol Ther. 2011;27(6):615-21.
59. Wu L, Arevalo JF, Berrocal MH, Maia M, Roca JA, Morales-Cantón V, et al. Comparison of two doses of intravitreal bevacizumab as primary treatment for macular edema secondary to central retinal vein occlusion: Results of the Pan American Collaborative Retina Study Group at 24 Months. Retina. 2010;30(7):1002-11.
60. Jiang Y, Mieler WF. Update on the Use of Anti-VEGF Intravitreal Therapies for Retinal Vein Occlusion. Asia Pac J Ophthalmol. 2017;6(6):546-53.
61. Park SP, Ahn JK. Changes of aqueous vascular endothelial growth factor and interleukin-6 after intravitreal triamcinolone for branch retinal vein occlusion.Clin Experiment Ophthalmol. 2008;36(9):831-5.
62. Ho M, Liu DTL, Lam DSC, Jonas JB. Retinal vein occlusions, from basics to the latest treatment. Retina. 2016;36(3):432-48.
63. Ip MS, Scott IU, VanVeldhuisen PC, Oden NL, Blodi BA, Fisher M, et al. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with observation to treat vision loss associated with macular edema secondary to central retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 5. Arch Ophthalmol. 2009;127(9):1101-14.
64. Haller JA, Bandello F, Belfort R, Jr., Blumenkranz MS, Gillies M, Heier J, et al. Dexamethasone Intravitreal Implant in Patients with Macular Edema Related to Branch or Central Retinal Vein Occlusion: Twelve-Month Study Results. Ophthalmology. 2011;118(12):2453-60.
INFORMAÇÃO DOS AUTORES


Financiamento: Declaram não haver
Funding: No specific financial support was available for this study
Conflitos de Interesse: Declaram não haver
Recebido em:
16 de Junho de 2020.
Aceito em:
2 de Novembro de 2020.