Francyne Veiga Reis Cyrino1; Breno Reis Almeida2
DOI: 10.17545/eoftalmo/2019.0003
RESUMO
A miopia é uma das ametropias mais comuns e sua prevalência está aumentando em todo o mundo, segundo publicações recentes. A membrana neovascular coroidal (MNVC) miópica ocorre em 5%–11% dos casos patológicos de miopia. O objetivo deste estudo foi avaliar a resposta da MNVC miópica ao tratamento com bevacizumabe ou ranibizumabe e analisar os resultados. O estudo consistiu em uma análise retrospectiva de 28 olhos de 28 pacientes com MNVC miópica tratados com um antagonista do fator de crescimento endotelial vascular, bevacizumabe ou ranibizumabe. Não houve recidiva após o tratamento e em 22 olhos, houve ganho de quatro ou mais linhas de visão. Não observamos correlação entre o surgimento da MNVC miópica, a idade e o grau de miopia. Tanto o ranibizumabe quanto o bevacizumabe demonstraram efeitos terapêuticos semelhantes no tratamento da MNVC miópica, sendo necessários um menor número de injeções em relação a degeneração macular relacionada à idade. É possível que haja uma relação entre o aparecimento dos sintomas, o tempo decorrido até o início do tratamento e a melhora da acuidade visual e sugerimos que se deva iniciar a terapia anti-VEGF o mais precocemente possível.
Palavras-chave: Miopia; Bevacizumab; Ranibizumab.
ABSTRACT
Myopia is one of the most common refractive errors whose prevalence has been reported to be increasing worldwide. Myopic choroidal neovascular membrane occurs in 5%–11% of pathological myopia cases. The aim of this study was to evaluate the response of myopic choroidal neovascular membrane (CNVM) treated with either bevacizumab or ranibizumab and to analyze the results. This study was a retrospective analysis of 28 eyes of 28 patients with myopic CNVM treated with anti-VEGF therapy (bevacizumab or ranibizumab. No correlation was observed between age and degree of myopia. Ranibizumab and bevacizumab demonstrated similar therapeutic effects in the treatment of myopic membranes with fewer injections unlike age-related macular degeneration. There could be a relationship between the onset of symptoms, treatment, and VA improvement. Efforts are needed to start anti-VEGF therapy as earlier as possible.
Keywords: Myopia; Bevacizumab; Ranibizumab.
RESUMEN
La miopía es una de las ametropías más comunes y su prevalencia se está incrementando en todo el mundo, según publicaciones recientes. La membrana neovascular coroidea (MNVC) miópica ocurre en un 5%-11% de los casos patológicos de miopía. El objetivo de este estudio fue evaluar la respuesta de la MNVC miópica al tratamiento con bevacizumab o ranibizumab y analizar los resultados. El estudio consistió en un análisis retrospectivo de 28 ojos de 28 pacientes con MNVC miópica tratados con un antagonista del factor de crecimiento endotelial vascular, bevacizumab o ranibizumab. No hubo recidiva después del tratamiento y en 22 ojos hubo aumento de cuatro o más líneas de visión. No observamos correlación entre el surgimiento de la MNVC miópica, la edad y el grado de miopía. Tanto el ranibizumab como el bevacizumab demostraron efectos terapéuticos semejantes en el tratamiento de la MNVC miópica, siendo necesarios un menor número de inyecciones con relación a la degeneración macular relacionada a la edad. Es posible que haya una relación entre el aparecimiento de los síntomas, el tiempo transcurrido hasta el inicio del tratamiento y la mejora de la acuidad visual, y sugerimos que se deba iniciar la terapia anti-VEGF lo antes posible.
Palabras-clave: Miopía; Bevacizumab; Ranibizumab.
INTRODUÇÃO
A miopia é uma das ametropias mais comuns, afetando aproximadamente 24% dos adultos com mais de 40 anos de idade. Estudos recentes relataram um aumento global na prevalência da miopia, especialmente na Europa e na Ásia Oriental1-5, onde 90% dos adolescentes são afetados, provavelmente devido a atividades em ambientes fechados e ao uso de dispositivos eletrônicos, como telefones celulares e computadores6.
A membrana neovascular coroidal (MNVC) é uma complicação séria que ocorre em aproximadamente 5%–11% dos casos de miopia patológica (MP)7, embora possa ocorrer em qualquer grau de miopia, com ou sem alterações degenerativas do fundo do olho8. Depois da degeneração macular relacionada à idade (DMRI), a MP é a segunda causa mais comum de neovascularização da coróide e afeta aproximadamente 62% dos pacientes míopes com idade inferior a 50 anos9. A MNVC geralmente ocorre no espaço subfoveal, podendo se apresentar inicialmente com metamorfopsia e levar a uma perda significativa de visão e/ou a cegueira legal, se não for tratada10.
Recentemente, os antagonistas do fator de crescimento endotelial vascular (agentes anti-VEGF) foram confirmados como a primeira escolha terapêutica para a neovascularização coroidal causada pela DMRI. Além disso, numerosos estudos que avaliaram a MNVC causada pela MP também relataram benefícios dos agentes anti-VEGF. O presente estudo foi feito para avaliar a resposta da MNVC miópica ao tratamento com bevacizumabe ou ranibizumabe e analisar os resultados.
MÉTODOS
Este estudo consistiu em uma análise retrospectiva de 28 olhos de 28 pacientes diagnosticados com MNVC miópica e submetidos a terapia com um agente anti-VEGF (bevacizumabe ou ranibizumabe) entre fevereiro de 2014 e julho de 2017, com pelo menos 6 meses de acompanhamento. Pacientes com diabetes, DMRI ou com MNVC inflamatória ou idiopática foram excluídos do estudo.
Todos os pacientes foram submetidos a uma avaliação oftalmológica completa, onde foi avaliada a melhor acuidade visual corrigida (MAVC) na apresentação inicial e após 6 meses, bem como o grau de miopia, padrões de angiofluoresceinografia (AF), imagens de tomografia por coerência óptica de domínio espectral (SD-OCT) antes e depois do tratamento e o número médio de injeções de agentes anti-VEGF necessárias para a cicatrização da MNVC. Foram administradas injeções intravítreas de agentes anti-VEGF de 5 a 10 dias após o diagnóstico. A escolha do medicamento antiangiogênico foi baseada na disponibilidade financeira do paciente ou na cobertura contratual do seu plano de saúde.
Após o início do tratamento, foi feito um acompanhamento mensal nos primeiros 3 meses depois das injeções intravítreas, com uma avaliação adicional aos 6 meses. Foram administradas novas injeções pro re nata (PRN) se o paciente estivesse sintomático ou se houvesse alguma alteração nas imagens de SD-OCT. Alterações da MAVC de duas linhas para mais ou para menos na tabela de Snellen foram consideradas indicativas respectivamente de melhora ou de piora.
RESULTADOS
Foram incluídos no estudo 28 olhos ao todo (de 4 homens e 24 mulheres), predominando as mulheres (86%). A idade variava entre 25 e 78 anos (média de 41,4 anos) e o grau de miopia variava de −3,00 a −16,50 D (média de −7,54 D). Três pacientes apresentavam cicatriz macular no olho contralateral, sem história de tratamento anterior de MNVC e com a acuidade visual variando de 20/200 a conta de dedos. O tempo desde o aparecimento dos sintomas variava entre 7 dias a 3 meses (média de 3,5 semanas) e a MAVC antes do tratamento variava de 20/40 a 20/200 (média de 20/100). Foram feitos exames de SD-OCT (Figura 1) e de AF em todos os pacientes; a AF evidenciou MNVC miópica clássica em todos os olhos.
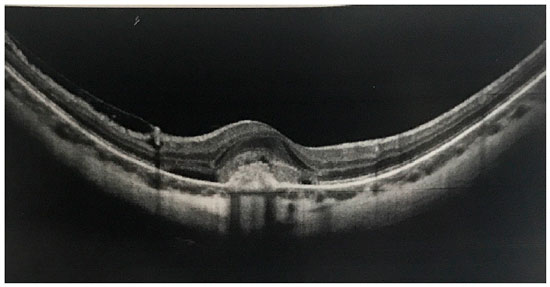
Foram administradas injeções intravítreas de um agente anti-VEGF no início do tratamento e, em caso de necessidade (PRN), após o tratamento. Um total de 16 olhos foram tratados com bevacizumabe intravítreo (1,25 mg em 0,5 mL) e 12 olhos foram tratados com ranibizumabe (0,5 mg em 0,5 mL). O número médio de injeções foi de 1,24 (faixa 1–5). Foi observada MNVC justafoveal em 17 olhos (60,71%) e subfoveal em 10 olhos (39,29%) e nenhum caso de MNVC extrafoveal (Figura 2).
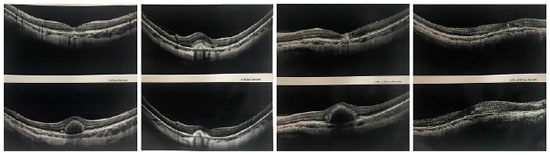
Um total de 20 olhos (71,42%) demonstrou regressão da MNVC com uma única injeção de bevacizumabe ou ranibizumabe. Um olho precisou de 3 injeções de bevacizumabe e 2 olhos precisaram de 3 injeções de ranibizumabe antes de se estabilizarem. Apenas um olho precisou de mais de três injeções de ranibizumabe (Figura 3). Após o término do tratamento, todos os casos de MNVC continuaram inativos e não apresentaram recidiva durante o período de acompanhamento (6 meses, 1–3 anos) (Figura 2).
Quanto ao resultado visual, 2 olhos (7,14%) permaneceram estáveis (sem melhora da visão), 4 olhos (14,28%) melhoraram a acuidade visual em três linhas de Snellen e 22 olhos (78,58%) tiveram uma melhora de quatro ou mais linhas. Não foi observada nenhuma diferença entre o ranibizumabe e o bevacizumabe em termos do resultado da acuidade visual pela tabela de Snellen.
DISCUSSÃO
A MNVC miópica é classificada como membrana neovascular do tipo 2, sendo em geral pequenas, com pequena quantidade de líquido e/ou hemorragia e nenhuma drusa, como também foi observado neste estudo. O acometimento contralateral ocorre em um terço dos pacientes em até 8 anos e o prognóstico é reservado na ausência de tratamento11.
No Japão, a MNVC miópica é a maior causa de cegueira unilateral ou bilateral, enquanto na China é a principal causa de cegueira em pessoas acima dos 40 anos de idade. São escassos os estudos sobre a prevalência de MNVC miópica no Brasil, mas no presente estudo, nenhum dos pacientes desenvolveu MNVC no olho contralateral durante os 3 anos de acompanhamento, em discordância com os achados de Leveziel et al12.
Também observamos uma incidência maior de MNVC justafoveal (60,71%), o que é consistente com os achados descritos anteriormente por Yodoi et al (54,5%).
Não foi observada nenhuma relação entre a idade, o grau de miopia, o número de injeções e o ganho de acuidade visual, como relatado anteriormente na literatura5,8,12. Porém, uma correlação entre o aparecimento dos sintomas, o início do tratamento e a melhora da acuidade visual foi observada neste estudo. Os pacientes que foram tratados assim que perceberam a perda de acuidade visual tiveram melhores resultados que aqueles tratados mais tarde (mais de um mês depois) e necessitaram de um menor número de injeções. Neste estudo, houve melhora da acuidade visual em 92,86% dos olhos tratados.
O tratamento da MNVC miópica envolve a terapia fotodinâmica (TFD) ou injeções de agentes anti-VEGF. Estudos retrospectivos demonstraram que a TFD pode acarretar uma piora da acuidade visual após 3 a 7 anos de tratamento, em decorrência de uma atrofia do epitélio pigmentar14-16. Ensaios clínicos randomizados indicam que a terapia antiangiogênica requer um menor número de injeções para tratar a MNVC miópica em relação a DMRI, resultado este semelhante ao observado em nosso estudo.
CONCLUSÃO
O ranibizumabe e o bevacizumabe demonstraram efeitos terapêuticos e segurança semelhantes no tratamento da MNVC miópica, apesar de suas diferenças na formulação. Diferentemente do que ocorre na DMRI, o número necessário de injeções é limitado, reduzindo a incidência de complicações e proporcionando uma melhora significativa da acuidade visual. Devido a relação entre o início dos sintomas, o tratamento e o ganho na acuidade visual, esforços devem ser feitos para iniciar a terapia anti-VEGF o mais precocemente possível.
REFERÊNCIAS
1. Avila MP, Weiter RJJ, Jalkh AE, Trempe CL, Pruett RC, Schepens CL. Natural history of choroidal neovascularization in degenerative myopia. Ophthalmology 1984; 91:1573-1581.
2. Hammond CJ. Myopia prevalence in Europe: cohort effect of increasing prevalence not fully explained by higher educational levels. Orlando, Florida: The Association for Research in Vision and Ophthalmology 2014 Annual Meeting. 2014 May 4 and 8.
3. Wu HM, Seet B, Yap EP, et al. Does education explain ethnic differences in myopia prevalence? A population-based study of young adult males in Singapore. Optom Vis Sci. 2001; 78: 234-239.
4. Feisal AA, Luong M, Munro M, Tufail A. The other CNVM: A review of myopic choroidal neovascularization treatment in the age of anti-vascular endothelial growth factor agents. Survey of Ophthalmol. 2015; 60(3):204-215.
5. Ohno-Matsui K, Lai TY, Lai CC, Cheung CM. Updates of pathologic myopia. Prog Retin Eye Res. 2016; 52:156-187.
6. Dolgie E. The myopia boom. Nature. 2015; 519:276-278.
7. Wong TY, Ferreira A, Hughes R, et al. Epidemiology and disease burden of pathologic myopia and myopic choroidal neovascularization: an evidencebased systematic review. Am J Ophthalmol. 2014; 157:9-25.e12.
8. Ohno-Matsui K, Yoshida T, Futagami S, et al. Patchy atrophy and lacquer cracks predispose to the development of choroidal neovascularisation in pathological myopia. Br J Ophthalmol. 2003; 87:570-573.
9. Neelam K, Cheung CM, Ohno-Matsui K, et al. Choroidal neovascularization in pathological myopia. Prog Retin Eye Res. 2012; 31:495-525.
10. Silva R. Myopic maculopathy: a review. Ophthalmologica. 2012; 228:197-213.
11. Ohno-Matsui K, Yoshida T, Futagami S, Yasuzumi K, Shimada N, Kojima A, et al. Patchy atrophy and lacquer cracks predispose to the development of choroidal neovascularisation in pathological myopia. Br J Ophthalmol. 2003; 87(5):570-573.
12. Leveziel N, Caillaux V, Bastuji-Garin S, Zmuda M, Souied EH. Angiographic and optical coherence tomography characteristics of recent myopic choroidal neovascularization. Am J Ophthalmol. 2013; 155:913-919.
13. Yodoi Y, Tsujikawa A, Nakanishi H, Otani A, Tamura H, Ojima Y, et al. Central retinal sensitivity after intravitreal injection of bevacizumab for myopic choroidal neovascularization. Am J Ophthalmol. 2009; 147:816-824.
14. Ng DS, Kwok AK, Chan CW. Anti-vascular endothelial growth factor for myopic choroidal neovascularization. Clin Exp Ophthalmol. 2012; 40(1):98-110.
15. Wolf S, Balciuniene VJ, Laganovska G, Menchini U, Ohno-Matsui K, Sharma T, Wong TY, Silva R, Pilz S, Gekkieva M; RADIANCE Study Group. RADIANCE: a randomized controlled study of ranibizumab in patients with choroidal neovascularization secondary to pathologic myopia. Ophthalmology. 2014; 121(3):682-692.
16. Chang LK, Spaide RF, Brue C, Freund KB, Klancnik JM Jr, Slakter JS. Bevacizumab treatment for subfoveal choroidal neovascularization from causes other than age related macular degeneration. Arch Ophthalmol. 2008; 126:951-954.


Financiamento: Declaram não haver
Conflitos de interesse: Declaram não haver
Recebido em:
11 de Outubro de 2018.
Aceito em:
1 de Fevereiro de 2019.